

Chronologie relative et échelle des temps

Cours
Chronologie relative : principes

Cours
L'échelle stratigraphique
La chronologie absolue

Cours
Chronologie absolue: principes

Cours
La datation au Carbone 14

Cours
La datation au Potassium Argon

Cours
La datation au Rubidium/Strontium
Exercices

Exercice
Vocabulaire
Chronologie absolue: principes
Structure des éléments chimiques

Tout atome est formé d'un noyau, contenant des protons et des neutrons, et d'électrons qui circulent autour du noyau.
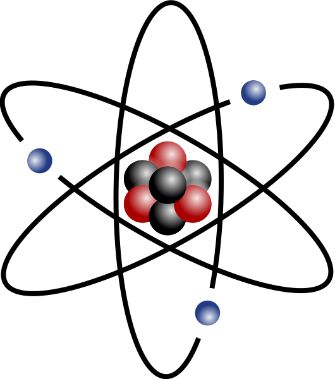
Structure d’un atome (Protons en rouge, neutrons en noir, électron en bleu)
atome stylisé avec trois orbites de modèle de Bohr et noyau stylisé.svg, SVG par Indolences . Recoloration et aplanissement de certains problèmes causés par Rainer Klute .via Wikimédia Commons, licence de documentation libre GNU, CC-BY-SA-3.0-migré, https://commons.wikimedia.org/wiki/File:Stylised_atom_with_three_Bohr_model_orbits_and_stylised_nucleus.svg
Informations sur les particules constitutives de l’atome
Particule | Masse (kg) | Charge électrique (C) |
Electron | ||
Proton | ||
Neutron |
Propriété
Parmi ces particules élémentaires constitutives de l’atome, les protons et les neutrons ont la même masse mais pas la même charge. Un neutron est électriquement neutre alors qu’un proton est chargé positivement. Un électron est chargé négativement.
Électrons et protons ont des masses différentes mais des valeurs de charge qui s’annulent. Il y a donc toujours autant d’électrons que de protons car un élément chimique est électriquement neutre.
Un atome est symbolisé par:
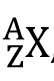
X est l'élément chimique considéré.
Neutrons et protons se trouvant dans le noyau, on les regroupe sous le terme de « nucléons ».
Possédant les masses les plus importantes, ils constituent la majeure partie de la masse globale de l’atome. La somme de leurs nombres est donc appelée le nombre de masse noté A.
Z est le nombre de protons que l’on trouve dans le noyau, on parle donc de numéro atomique.
Ainsi en lisant la symbolisation de l’élément chimique on peut retrouver toutes les informations concernant sa structure :
A = nombre de protons + nombre de neutrons
Z = nombre de protons
N = Nombre de neutrons = A – Z
Exemple

Propriété
Ainsi, un ion est un atome portant une charge électrique car ayant gagné ou perdu un ou plusieurs électrons.
Un ion positif est un atome qui a perdu un électron, on parle de cation.
Un ion négatif est un atome qui a gagné un électron on parle d’anion.
Définition
Un élément chimique est une entité définie par l'ensemble des atomes ou ions, isolés ou associés à d'autres éléments, de même numéro atomique Z.
Exemple
L'élément cuivre dans le métal (atome) et la solution de sulfate de cuivre (ion cuivre).
Tous les éléments chimiques sont rassemblés dans un tableau par numéro atomique Z croissant de gauche à droite et de haut en bas. C’est la classification périodique de Mendeleïv chimiste russe qui l’a publiée en 1869.
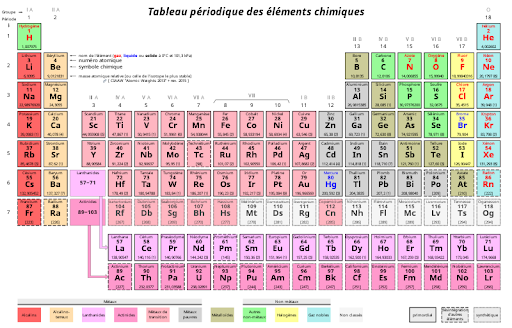
Classification périodique des éléments chimiques
800px-Tableau_périodique_des_éléments.svg, par Détartreur , Michka B via Wikimédia Commons, CC-BY-SA-3.0,2.5,2.0,1.0, https://commons.wikimedia.org/wiki/File:Tableau_p%C3%A9riodique_des_%C3%A9l%C3%A9ments.svg
La radioactivité
Pour un même élément chimique, le nombre N de neutrons peut varier. Comme leur nombre de proton Z reste le même, alors cela signifie que A varie aussi car N= A-Z.
Ces atomes sont appelés isotopes de l'élément chimique considéré.
Exemple


Les propriétés chimiques des isotopes d'un élément chimique sont les mêmes.
Le rangement des isotopes se fait dans un tableau : de la gauche vers la droite par la valeur croissante de N et du bas vers le haut par la valeur croissante de Z.
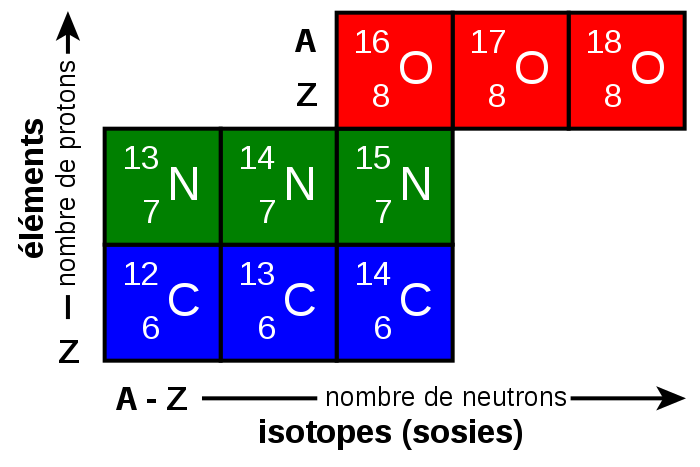
Classification des isotopes
700px-Isotope_CNO.svg par Lucquessoy via Wikimédia Commons, CC-BY-SA-3.0, https://commons.wikimedia.org/wiki/File:Isotope_CNO.svg
Propriété
Il existe des isotopes stables et des isotopes instables.
Un isotope instable tend naturellement à retourner à l’état stable grâce à une réaction de désintégration nucléaire. Cette réaction nucléaire ne concerne que la structure du noyau et s’accompagne de l’émission de rayonnements naturels.
Les scientifiques ont identifié plusieurs rayonnements radioactifs, qu'ils ont nommés avec l'alphabet grec : rayonnements alpha, bêta, gamma.
Lors de l'étude des rayonnements radioactifs, les scientifiques ont cherché à savoir s'ils étaient chargés électriquement. Pour cela, ils les ont fait passer dans un champ magnétique, pour vérifier s'ils étaient déviés. Il se trouve que certains d'entre eux le sont, ce qui signifie qu'ils ont une charge électrique, alors que d'autres ne le sont pas.
Pour ceux qui sont déviés, l'angle de déviation varie suivant ce qui est émis par l'atome, signe que les rayonnements n'ont pas tous la même masse. Les scientifiques ont alors identifié plusieurs rayonnements :
le rayonnement alpha, chargé positivement, avec une masse importante : émission d’un noyau d’Hélium;
le rayonnement bêta, chargé positivement ou négativement, avec une masse plus faible : émission d’un électron ou d’un anti-électron (positron);
le rayonnement gamma, sans charge et sans masse, identique à de la lumière : émission d’un photon;
le rayonnement neutronique, non-chargé, avec la même masse que le neutron : émission d’un neutron (rare).

Déviation du rayonnement nucléaire dans un champ magnétique
433px-Deflection_of_nuclear_radiation_in_a_magnetic_field_en.svg, Qniemiec , vecteur par Adam Rędzikowski, CC-BY-SA-4.0,3.0,2.5,2.0,1.0, via Wikimédia Commons, https://commons.wikimedia.org/wiki/File:Deflection_of_nuclear_radiation_in_a_magnetic_field_en.svg
La loi de décroissance radioactive
L’élément ayant tendance à se désintégrer est appelé « élément père » noté P et l’élément stable obtenu est appelé « l’élément fils ». Cet élément est radiogénique, c’est à dire provenant d’une désintégration. Pour le distinguer des éléments stables identiques non issus de la désintégration nucléaire et présents au départ (Fo), on le nomme F’.
Donc P→ F’
Ainsi, le nombre d'éléments P diminue en fonction du temps tandis que le nombre d'éléments-fils produits augmente. Comme chaque élément père est remplacé par un élément fils, le nombre total d’éléments du système reste le même : on dit que le système est clos ou fermé, il n'y a pas d'apports extérieurs ou de pertes.
On appelle Demi-vie ou période, le temps nécessaire à la diminution de moitié des noyaux instables lors de leur passage en atomes stables. On la nomme T.
Ainsi à T on a :
A 2T on a :
A 3T on a :
A 4T on a :
Soit la formule à :
On obtient la courbe de désintégration radioactive ci-dessous.
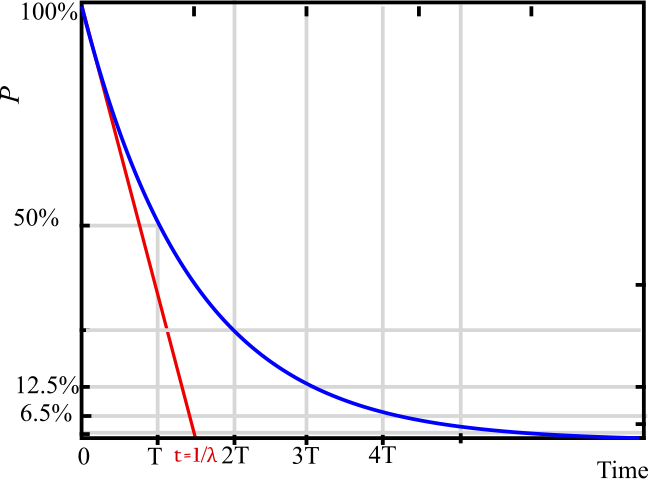
Courbe de désintégration radioactive
Activity decay.svg, par Series_RC_resistor_voltage.svg : Utilisateur: Ktims, travail dérivé: Pieter Kuiper ( discussion ),via Wikimédia commons, domaine publique modifié par Sandra Rivière
La constante de désintégration lambda, peut se déterminer graphiquement grâce à la tangente à l’origine qui intercepte l’axe du temps à l’abscisse:
Problématique
Peut-on trouver une fonction dépendante du temps permettant de trouver le nombre d’éléments P non désintégrés à un instant quelconque qui n’est pas forcément multiple de cette demi-vie ? P(t) ?
Cette valeur est négative car on a une diminution du nombre d’éléments radioactifs au cours du temps. Cette valeur est proportionnelle au nombre total d’éléments présents au début et dépend de la constante de désintégration λ et du temps. La constante de désintégration (ou constante radioactive) d'un radioisotope est le rapport entre l'activité d'un échantillon et le nombre d'atomes du radioisotope présents dans l'échantillon.
Comme les désintégrations sont très rapides, dt tend vers 0. On obtient alors cette dérivée :
On a donc une équation différentielle à résoudre pour connaître P en fonction du temps.
On commence par regrouper les variables, on obtient donc :
On intègre chaque côté de l’équation :
La primitive de :
C'est :
La primitive de :
C'est :
Donc:
On veut isoler P. On prend l’exponentielle de chaque côté de l’équation :
On obtient :
L’exponentielle d’une constante est égale à une autre constante que l’on va nommer c’.
Pour trouver c’ , on regarde ce qu’il se passe à t=0.
A t=0 on a:
et donc:
Donc :
Donc la constante c’ c’est simplement la quantité initiale d’éléments radioactifs Po.
Du coup on obtient :
On peut donc déterminer la valeur de λ à partir de cette formule à la demi-vie :
À la demi-vie T on a :
Or à la demi-vie on peut aussi dire que :
On pose l’égalité :
Soit :
Soit :
Soit :
Soit :
Soit :
Soit :
On peut maintenant éditer la formule permettant de calculer le temps écoulé :
On a :
Donc :
Donc :
Donc :
Donc :
Donc :

Cette formule sera adaptée selon le choix de l’isotope utilisé pour dater un élément géologique.
Datation d’éléments géologiques et choix de l’isotope
Tout d’abord, le choix va se faire en fonction de la période de l’isotope :
Une fois le système fermé, la quantité d’isotopes susceptibles de se désintégrer diminue et lorsque la teneur en éléments pères devient trop faible, les dosages sont difficiles à faire. La datation n’est par conséquent valide que si l’on mesure des durées allant du centième à dix fois la période T de l’isotope choisi.
On commence donc par appréhender l’âge de l’objet par chronologie relative afin de choisir l’isotope le plus pertinent pour la datation absolue.
Ensuite, il existe trois types de radiochronomètres en fonction des conditions de fermeture du système :
Lorsque l’élément père est connu : cas de la méthode du 14C.
Lorsque l’élément père est inconnu :
avec absence d’élément fils dans l’objet au moment de la fermeture du système : cas de la méthode K/Ar
avec une quantité inconnue d’éléments fils dans l’objet au moment de la fermeture du système : cas de la méthode Rb/Sr.
Revenir au chapitre
Commentaires





