

Cours écrit : Les enzymes, des biomolécules aux propriétés catalytiques
Il existe plusieurs catégories d’enzymes.
Exemple
Par exemple, les enzymes digestives permettent la transformation des aliments en nutriments pour les rendre absorbables au niveau de l’intestin.
Il existe également des enzymes intervenant dans la réplication ou encore la transcription de l’ADN.

Les enzymes sont donc des molécules qui catalysent des réactions métaboliques.
Définition
En chimie, un catalyseur est espèce qui augmente la vitesse de transformation sans figurer dans l’équation de la réaction et sans modifier la composition du système à l’état final.
Propriétécatalyseur
Il possède plusieurs caractéristiques :
il accélère une réaction
il agit sur des molécules différentes même s’il a la même action
il peut agir à faible dose
il peut agir à 100°C
il est retrouvé intact à la fin de la réaction
Remarque
Les enzymes sont différentes des catalyseurs chimiques en ce sens qu’elles ne peuvent agir à 100°C et n’agissent pas sur différentes molécules. Elles fonctionnent à la température du corps, c’est pourquoi on parle de « biocatalyseur ». Aux basses températures, l’inactivation des enzymes est réversible car elles ne sont pas dénaturées. Cependant, à partir de 50°C, les enzymes subissent une dénaturation thermique et sont détruites.
Les enzymes sont nécessaires au métabolisme des cellules car à 37°C les réactions chimiques seraient trop lentes pour apporter aux cellules ce dont elles auraient besoin.
Propriété
Une enzyme catalyse un seul type de réaction sur un seul type de molécule appelée « substrat ». Il y a donc spécificité d’action et spécificité de substrat : on parle de double spécificité.
Les enzymes sont des protéines constituées d’acides aminés. Elles possèdent donc une structure tridimensionnelle dans laquelle on va observer un site de fixation du substrat ou site actif. Ce site de fixation se décline en un site de reconnaissance et un site de catalyse.
Dans le site de reconnaissance il y a des acides aminés qui effectuent des liaisons faibles avec le substrat stabilisant le complexe nommé ainsi complexe enzyme-substrat.
Le site actif de l’enzyme et le substrat sont alors complémentaires (tels une clé dans une serrure), ils ajustent mutuellement leurs formes respectives permettant la fixation du substrat.
Ceci explique la spécificité des enzymes à un seul type de substrat.
Exemple
Ainsi l’amylase est une enzyme qui catalyse l’hydrolyse des chaînes polyglucidiques (comme l’amidon ou le glycogène) et qui ne peut pas agir sur d’autres substrats tels que le saccharose par exemple.
Dans le site de catalyse, des acides aminés sont responsables de la transformation du substrat en produit. On parle d'acides aminés catalytiques. La nature des acides aminés en contact avec le substrat explique la spécificité d’action.
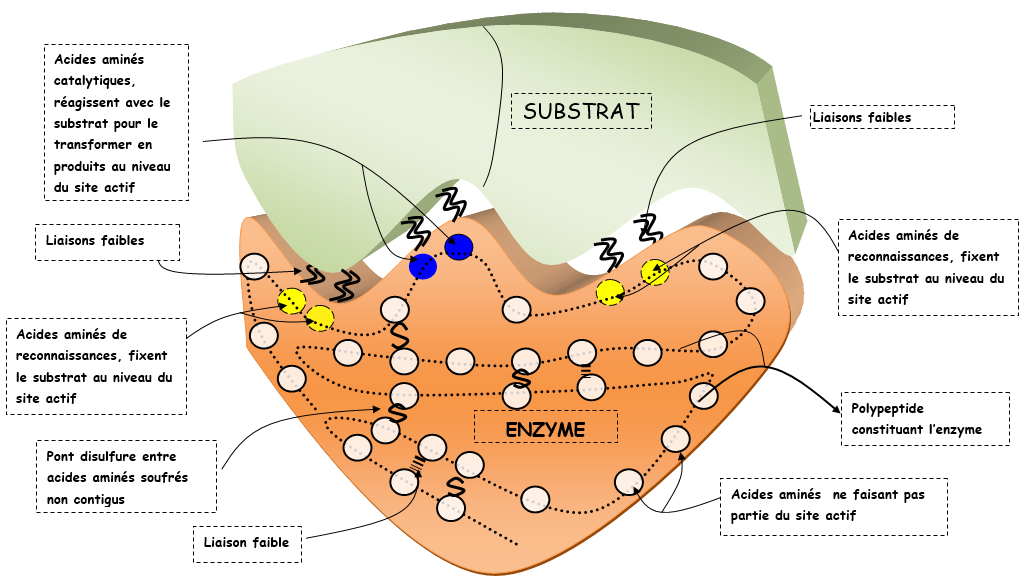
Structure d’une enzyme
http://svt.ac-dijon.fr/schemassvt/spip.php?article1418
L’enregistrement de la quantité de produit formé en fonction du temps pour une concentration en enzymes fixe mais pour des concentrations en substrat variables se fait par EXAO (expérimentation assistée par ordinateur).
Il permet d’obtenir pour chaque concentration en substrat testée, une courbe [P] = f(T) dont la pente de la tangente à l’origine de la cinétique correspond à la vitesse initiale de réaction.
La vitesse d’une réaction enzymatique est définie comme la quantité de substrat dégradé ou de produit formé par unité de temps, elle s'exprime généralement en.
À l’aide de ces données il est possible de tracer la courbe représentant l’évolution de la vitesse initiale d’une enzyme en fonction de la concentration en substrat vi =f(S).
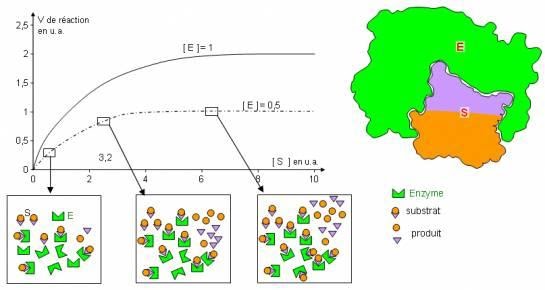
Courbe représentant l’évolution de la vitesse initiale de réaction en fonction de la concentration en substrat
http://www.ac-grenoble.fr/disciplines/svt/file/ancien_site/log/1_s/1s_genotype/1s_genphe_ch2.htm
La vitesse de réaction initiale dépend de la capacité d’une enzyme à se lier à son substrat.
Pour une concentration en substrat nettement inférieure à la concentration en enzymes, l’enzyme n’est pas saturée et la vitesse initiale de réaction sera faible. Plus la concentration en substrat se rapprochera de la concentration en enzymes plus la vitesse initiale de catalyse sera élevée. La vitesse initiale maximale sera atteinte quand la concentration en substrat sera égale à la concentration en enzyme : on dit que l’enzyme est « saturée ».
Pour toute concentration en substrat supérieure à la concentration en enzyme, la vitesse initiale de réaction restera la même qu’en cas de saturation, une enzyme ne pouvant pas transformer plus d’une molécule de substrat à la fois, d’où le palier sur la courbe vi =f(S).
Ainsi la quantité de produit formé est limitée par la concentration en enzymes.
Théorème
Michaelis et Menten ont démontré en 1913 l’existence du complexe enzyme-substrat et déterminé que la vitesse maximale était atteinte quand l’enzyme était saturée. Ils ont défini la constante Km correspondant à la valeur de la concentration en substrat pour laquelle la vitesse de réaction enzymatique est égale à la moitié de la vitesse maximale. Cette constante dite « constante de Michaelis-Menten » est donc déterminée graphiquement à l’aide du graphique représentant l’évolution de la vitesse initiale en fonction de la concentration en substrat.
Ainsi la vitesse initiale Vi de la réaction catalytique en fonction de la concentration substrat est calculable par la formule suivante :
Vi = (Vmax x [S]) / (Km + [S]).

Michaelis Menten curve 2.svg par Thomas Shafee via Wikimédia Commons, CC-BY-4.0, modifié par Sandra Rivière, https://commons.wikimedia.org/wiki/File:Michaelis_Menten_curve_2.svg?uselang=fr
Les enzymes étant des protéines, leur production dépend donc de l’expression de certains gènes. Chaque cellule de l’organisme détient le génome complet. Cependant chaque cellule de l’organisme n’exprime pas la totalité des gènes. L’expression est régulée en amont d’un gène grâce à une séquence régulatrice. Ainsi les gènes correspondant à des enzymes non utiles dans une cellule d’un organe spécialisé seront réprimés. Les enzymes constituent donc un marqueur de la spécialisation cellulaire.
Exemple
La régulation de la glycémie est un exemple de spécialisation enzymatique cellulaire.
Le foie est le seul organe capable de libérer du glucose dans le sang, qu’il produit à partir du glycogène. Pour cela il hydrolyse les molécules de glycogène (on parle de glycogénolyse) ce qui donne des molécules de glucose-6-phosphate (G6P). Ces dernières sont transformées en molécules de glucose grâce à une enzyme, la glucose-6-phosphatase, pour ensuite être libérées dans le sang et être utilisables par les autres cellules de l’organisme. Or le muscle est aussi capable de transformer du glycogène en glucose mais les cellules musculaires ne peuvent pas libérer ce glucose dans la circulation sanguine. En effet le muscle ne possède pas la glucose-6-phosphatase.
Ainsi le fait de posséder ou pas la glucose-6-phosphatase donne au foie et aux muscles des fonctions différentes: celle de libérer le glucose dans le sang pour augmenter la glycémie ou celle de libérer du glucose dans les cellules musculaires pour le consommer afin de fournir un effort.

Donc les cellules possèdent des équipements enzymatiques spécifiques à leur fonction.
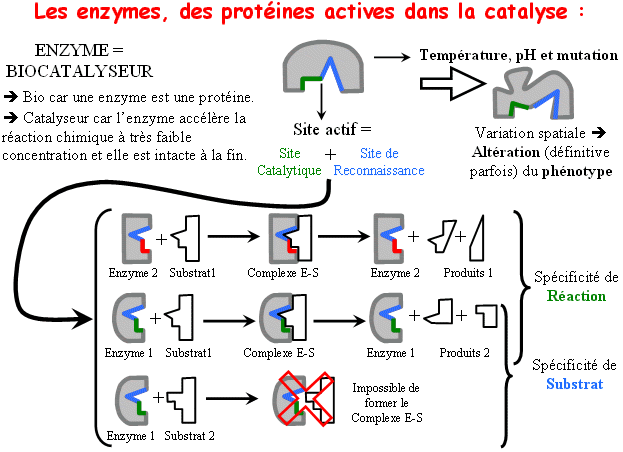
Les enzymes, des biocatalyseurs
http://www.ac-grenoble.fr/disciplines/svt/file/ancien_site/log/1_s/1s_genotype/1s_genphe_ch2.htm- ! Schéma d’origine modifié par Caroline Helfer
Revenir au chapitre
Commentaires
Farahon
1
Super cours, c'est beaucoup plus clair maintenant !







