

Polarité des molécules

Cours
Polarité des molécules
Polarité des molécules
Sommaire
Le moment dipolaire
Définition
Une molécule, ce sont des atomes liés entre-eux par des liaisons covalentes, correspondant à la mise en commun de deux électrons par deux atomes.
Les électrons ne sont pas répartis également : il va y avoir apparition d'une charge (= manque d'électrons) d'un côté et d'une charge (= excès d'électrons) de l'autre côté.
Un dipôle électrique va se former : c'est un ensemble de deux pôles chargés différemment.
Le dipôle est caractérisé par son moment dipolaire.
Propriété
Le moment dipolaire est :
colinéaire à la liaison
orienté du vers le
exprimé en debye :
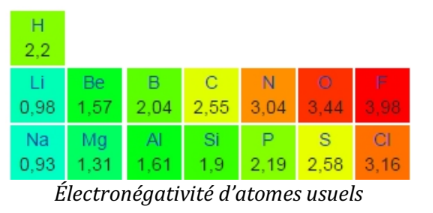
L'électronégativité
Définition
Tous les atomes n’ont pas la même capacité à capter des électrons.
L’électronégativité est une grandeur sans unité qui traduit l’aptitude d’un atome à attirer vers lui le doublet d’électrons qui le lie à un atome .
Elle est notée (se dit « ki »).
Propriété
L’atome qui est le plus électronégatif dans une liaison va alors attirer le doublet d’électron et aura une charge partielle négative tandis que l’autre atome aura une charge partielle positive .
Définition
Une liaison covalente entre deux atomes et est polarisée si ces deux atomes ont des électronégativités différentes.
Polarité des molécules
Définition
Une molécule est polaire si les positions moyennes des charges partielles positives et négatives ne sont pas confondues.
Une molécule est apolaire (non polaire) dans le cas contraire.
La géométrie de la molécule aura donc une importance dans la polarité des molécules.
Revenir au chapitre
Commentaires





