

Diversification et Transfert de Gènes

Cours
Transferts horizontaux et complexification des génomes
Diversification et Théorie de l'Endosymbiose

Cours
L'endosymbiose, mécanisme évolutif majeur
Exercices

Exercice
Vocabulaire
Transferts horizontaux et complexification des génomes
Sommaire

Lors de la reproduction sexuée, du matériel génétique est transmis de manière verticale des parents aux enfants. Il existe des transferts de matériel dits « horizontaux » car ils ont lieu en dehors de toute filiation et s’effectuent entre individus de la même espèce (transferts intraspécifiques) ou pas (transferts interspécifiques).
Ces transferts de matériel modifient le génome de l’espèce receveuse. Si cette modification confère un avantage sélectif elle sera conservée : le génome aura ainsi été complexifié.
Transferts horizontaux chez les bactéries : mécanismes
Les bactéries, organismes unicellulaire procaryotes, sont faciles à élever en laboratoire et ont donc fait l’objet de nombreuses recherches en génétique qui ont abouti à de grandes avancées médicales.
Mise en évidence des transferts horizontaux et découverte de l’ADN
Les transferts horizontaux ont été décrits pour la première fois en 1928 chez les bactéries par Griffith.

Fred Griffith, 1936
Fred Griffith et "Bobby" 1936.jpg, par Coburn, Alvin F., gracieuseté de Joshua Lederberg. Via Wikimédia Commons, domaine publique, https://commons.wikimedia.org/wiki/File:Fred_Griffith_and_%22Bobby%22_1936.jpg
Fred Griffith travaillait sur des souches de pneumocoques :
la souche R pour « rough » donne des colonies qui présentent un aspect rugueux
la souche S pour « smooth » donne des colonies qui présentent un aspect lisse qu’elles doivent à une capsule de polysaccharides que les bactéries synthétisent autour d’elles.
On sait aujourd’hui que cette différence entre les deux souches est due à une mutation chez la bactérie R touchant le gène codant l’enzyme responsable de la synthèse de la capsule.
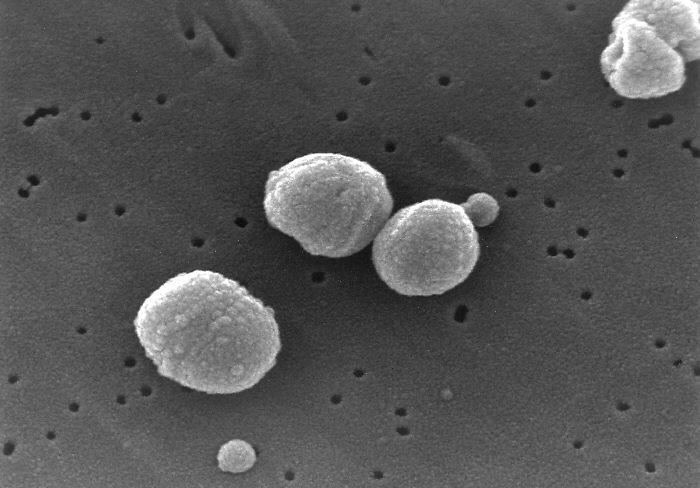
Streptococcus pneumoniae observées au microscope électronique à balayage
Streptococcus pneumoniae.jpg PD-USGov-HHS-CDC, domaine publique, via Wikimédia Commons, https://commons.wikimedia.org/wiki/File:Streptococcus_pneumoniae.jpg
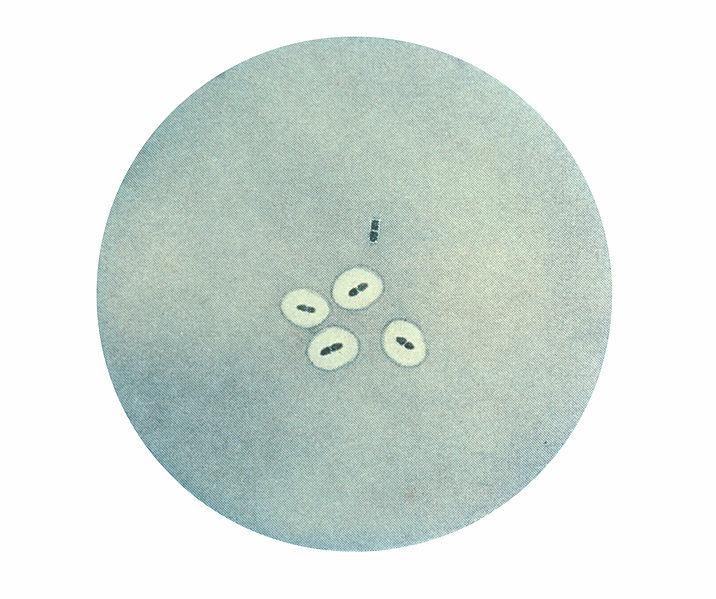
Photomicrographie de couples de bactéries Streptococcus pneumoniae révélant un gonflement capsulaire à l'aide du test de Neufeld-Quellung.
Pneumococcus CDC PHIL 2113.jpg, PD-USGov-HHS-CDC, domaine publique, via Wikimédia Commons, https://commons.wikimedia.org/wiki/File:Pneumococcus_CDC_PHIL_2113.jpg
La souche S est mortelle pour la souris lorsqu’elle lui est injectée alors qu’au contraire la souche R ne présentant pas de capsule n’est pas nocive pour la souris.
Problématique
La question était de savoir pour la souche S, si c’était la capsule qui était létale ou la bactérie en elle-même.
Pour ce faire Griffith chauffa des bactéries de souche S de manière à les tuer mais sans détruire la capsule. L’injection de bactéries S tuées par la chaleur ne provoqua pas la mort des souris. Il en conclut que la capsule n’était pas responsable de la maladie mais que la bactérie de souche S possédait un caractère infectieux que la bactérie de souche R ne possédait pas.

On sait aujourd’hui que les bactéries S produisent des protéines sur leur capsule leur permettant d’adhérer aux cellules pulmonaires.
Il décida ensuite d’injecter conjointement des bactéries S chauffées mélangées à des bactéries R vivantes. Cette fois les souris moururent. Il en conclut que les bactéries R au contact des restes de bactéries tuées avaient acquis le caractère pathogène qu’elles ne possédaient pas précédemment. Elles avaient donc récupéré un facteur responsable de leur pathogénicité.
Il a nommé ce phénomène « transformation bactérienne ». Il restait à découvrir la nature de ce facteur.

Expériences de Griffith
Griffith experiment-FR.svg, par Griffith_experiment.svg, par Madeleine Price Ball, travail dérivé: Chandres ( discussion ), via wikimedia commons, CC-BY-SA-3.0-migré, https://commons.wikimedia.org/wiki/File:Griffith_experiment-FR.svg, CC zéro, https://commons.wikimedia.org/wiki/File:Griffith_experiment.svg
Dans les années 40, trois chercheurs, Avery, MacLeod (des canadiens) et McCarty (un américain), ont démontré que la substance transformante qui passait des bactéries S mortes aux bactéries R vivantes n’était pas de nature protéique comme la communauté scientifique de l’époque le pensait mais plutôt de nature nucléique, c’est-à-dire de l’ADN.
Ils reprirent la dernière expérience de Griffith avec une légère variante : les bactéries S mortes avaient été broyées au blender puis traitées avec une enzyme digestive avant de les mélanger aux bactéries R vivantes.
Afin de déterminer la nature du facteur, ils réalisèrent deux essais de transformation bactérienne en ajoutant un enzyme destinée à détruire le facteur transformant impliqué dans la transformation des bactéries R.
Un premier essai a été réalisé avec une protéase dont l’action consiste à digérer les protéines.
Un deuxième essai a été réalisé avec une DNAase dont l’action consiste à digérer l’ADN.
Si le facteur était de nature protéique, alors les bactéries du premier essai ne devaient pas devenir pathogènes. Si le facteur était de nature nucléique, alors les bactéries du deuxième essai ne devaient pas devenir pathogènes.

Expérience de Avery, MacLeod et McCarty
Griffith experiment-FR.svg, par Griffith_experiment.svg : 'par Madeleine Price Ball, travail dérivé: Chandres ( discussion ), modifié par Sandra Rivière, via Wikimedia commons, CC-BY-SA-3.0-migré, https://commons.wikimedia.org/wiki/File:Griffith_experiment-FR.svg, CC zéro, https://commons.wikimedia.org/wiki/File:Griffith_experiment.svg
Les résultats étaient éloquents :
les souris du premier essai sont mortes et contenaient des souches S vivantes : la protéase n’a pas détruit le facteur transformant indiquant que celui-ci n’était donc pas de nature protéique.
les souris du deuxième essai étaient vivantes : la DNAase avait détruit le facteur transformant indiquant que celui-ci était donc bien de nature nucléique.

Ainsi les bactéries R étaient modifiées par de l’ADN provenant des bactéries S mortes et libéré quand les cellules chauffées avaient été dénaturées.
Pour la première fois, il avait été prouvé que la molécule d’ADN était capable de véhiculer une information.
Conclusion
Les bactéries peuvent être donc modifiées par un ADN libre, on parle de transformation.
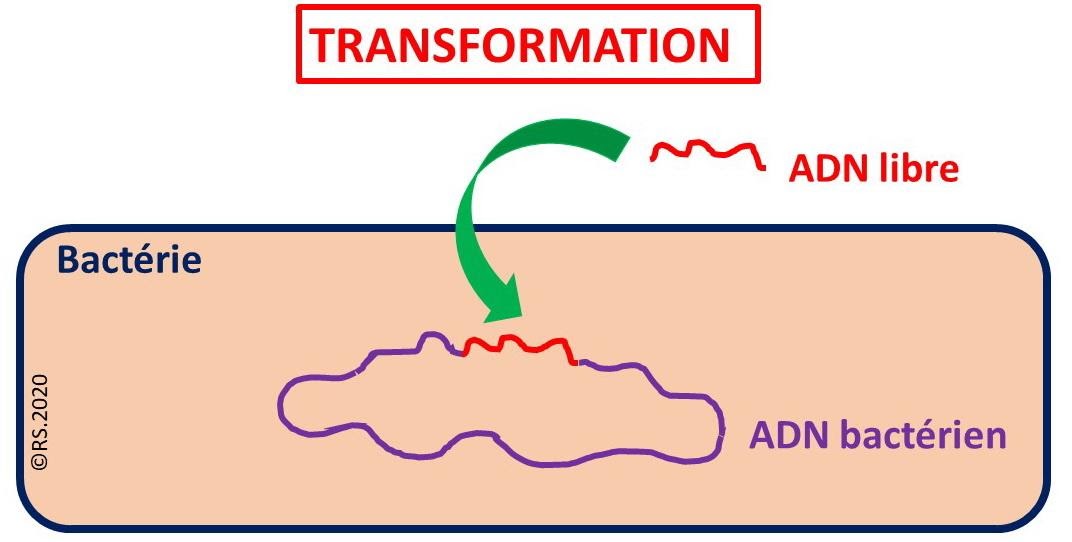
La transformation bactérienne
Découverte d’un transfert entre bactéries vivantes
C’est Joshua Lederberg, généticien et microbiologiste américain, qui en étudiant la reproduction de la bactérie Escherichia coli, découvrit en 1947 que les bactéries d’une même espèce pouvaient échanger des gènes sans reproduction selon un mécanisme appelé « conjugaison bactérienne ». Cette découverte lui valut de partager en 1900 le prix Nobel de médecine.
Il réalisa cette découverte en travaillant sur 2 mutants d’Escherichia coli :
La souche A était déficiente pour la synthèse des trois acides aminés (Biotine, phénylalanine et cystéine). Elle ne pouvait donc se développer que sur un milieu enrichi en ces 3 acides aminés.
La souche B était déficiente pour la synthèse de 3 autres acides aminés (thréonine, leucine et thiamine.
Il réalisa deux cultures témoin en boîte de pétri sur un milieu minimum ne contenant aucun des 6 acides aminés : une boîte de culture ne possédant que la souche A et une boîte de culture ne possédant que la souche B. Ainsi en théorie, aucune des 2 souches de bactéries ne devrait pouvoir survivre sur ce milieu. Il mélangea dans un milieu liquide les deux souches mutantes puis étala la culture sur ce milieu gélosé minimum dans une troisième boite de pétri.

Joshua Lederberg dans son laboratoire
Joshua Lederberg lab.jpg, domaine publique, via Wikimedia commons, https://commons.wikimedia.org/wiki/File:Joshua_Lederberg_lab.jpg
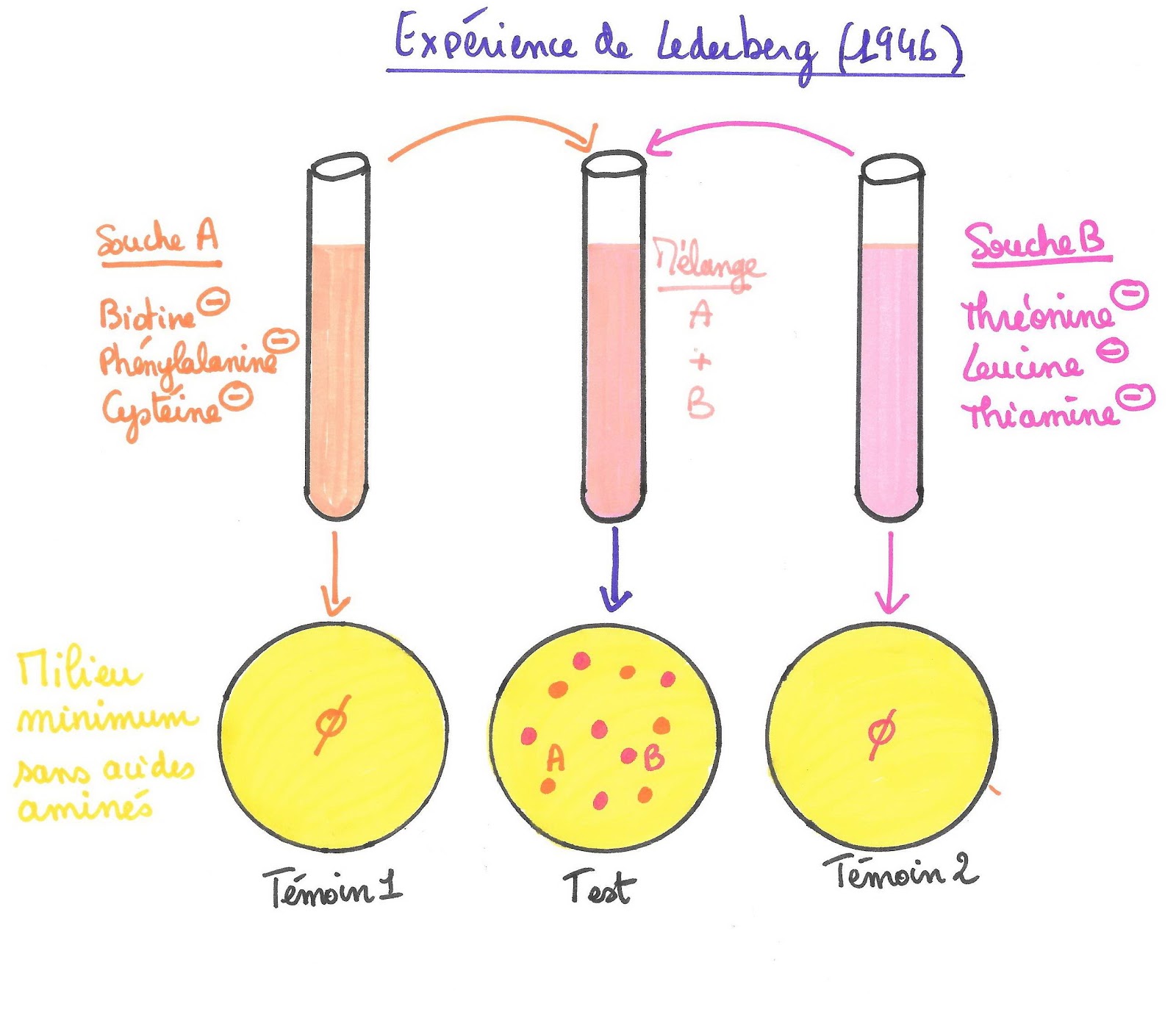
Résultats obtenus par Joshua Lederberg après 2 semaines de culture à 38°C
©RS.2020
Il constata une semaine plus tard que les témoins ne présentaient aucune population bactérienne alors que la culture issue du mélange des deux souches présentait des colonies bactériennes pour chacune des 2 souches.
Il en conclut que les bactéries de la souche A avaient pu récupérer les gènes permettant la synthèse de la biotine, de la phénylalanine et de la cystéine présents chez la souche B. Inversement les bactéries de la souche B avaient récupéré les gènes permettant la synthèse de la thréonine, leucine et thiamine que possèdent les bactéries de la souche A.
Il y avait donc eu des échanges de gènes entre des bactéries vivantes par contact les unes aux autres. Ce fut la découverte du mécanisme de « conjugaison bactérienne ». Cette découverte lui valut de partager en 1900 le prix Nobel de médecine.
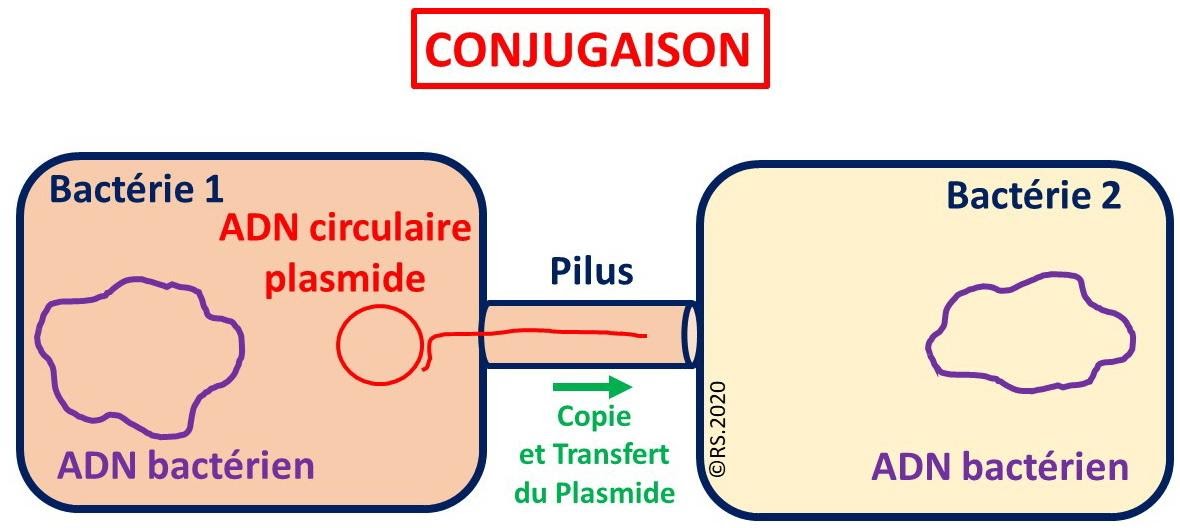
Principe de la conjugaison bactérienne

On sait aujourd’hui que les bactéries peuvent s’échanger de courts fragments d’ADN circulaires appelé plasmides. Ces derniers ont été découverts par Esther Lederberg, l’épouse de Joshua Lederberg
Propriété
Les morceaux d’ADN présents dans les cellules bactériennes se répliquent de manière autonome et séparément de l’ADN chromosomique.
Une bactérie donneuse va émettre un pilus, sorte de tube protéique creux qui se connectera à une bactérie receveuse. Un pont cytoplasmique s’effectue entre les 2 bactéries. Le plasmide de la bactérie donneuse va subir une réplication et le transfert de la copie vers la bactérie receveuse se fera dans la foulée. La bactérie donneuse conservera donc toujours l’élément génétique malgré son transfert vers la bactérie réceptrice. Comme le plasmide transféré possède un gène codant pour le facteur F responsable de la synthèse des pili sexuels, la bactérie receveuse devient donc à son tour capable de produit des pili sexuels, elle devient donneuse douée de conjugaison.
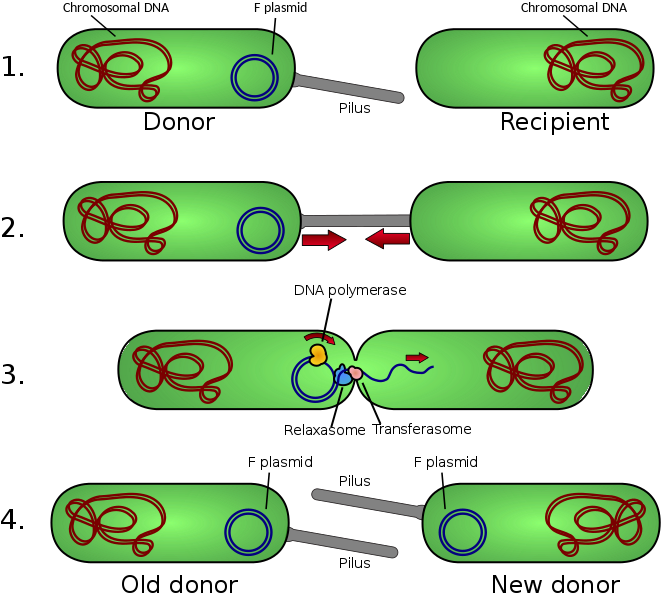
La conjugaison bactérienne en détail
Conjugation.svg, par Adénosine, via Wikimédia Commons, CC-BY-SA-3.0, https://commons.wikimedia.org/wiki/File:Conjugation.svg
Découverte d’un transfert via un vecteur
En 1952, Norton ZINDER et Joshua LEDERBERG tentent d'obtenir des bactéries recombinantes par conjugaison entre deux souches de Salmonella typhimurium :
La souche « LA 22 » était déficiente pour la production d’acide aminé « histidine » mais compétente pour la production de tryptophane. Elle est donc nommée « LA 22 his- trp+ »
La souche « LA 2 » était compétente pour la production des 2 acides aminés. Elle est donc nommée « LA 2 his+ trp+ »
Ils espéraient obtenir des recombinants « LA22 his+ trp+ » par conjugaison. Ils ont réalisé plusieurs techniques de culture : soit sur boite de pétri soit dans un tube en U.
Ils avaient remarqué que le taux de recombinants « LA 22 his+ trp+ » n’était pas modifié quand ils installaient dans la courbure du tube en U, un filtre empêchant le contact entre les bactéries mais laissant circuler le liquide de culture. Si la recombinaison s’effectuait ce n’était donc pas par conjugaison. Il fallait trouver un vecteur capable de transporter de l’ADN d’une bactérie à une autre.

Culture des souches LA 22 et LA 2 dans un tube en U équipé d’un filtre
©RS.2020
Esther Lederberg, l’épouse de Joshua, elle aussi microbiologiste, avait quelques temps auparavant, mis en évidence l’existence d’un bactériophage, un virus spécialisé dans l’infection des cellules bactériennes et qu’elle avait nommé « phage lambda ».
Propriété
Ce bactériophage a la particularité d’infecter une bactérie et de s’y multiplier. Le phage λ se fixe sur la membrane bactérienne, libère son matériel génétique dans le cytoplasme. Le chromosome bactérien est lysé en petits morceaux et la machinerie cellulaire est ensuite détournée pour produire les protéines de la capside virale. Ensuite la capside est reconstituée enfermant l’ADN viral répliqué et les nouveaux virus sortent de la cellule, la détruisant au passage. C’est un cycle dit lytique car il y a lyse de la cellule infectée.
Elle avait également remarqué que parfois le pouvoir lytique du phage λ « sautait » plusieurs générations et en a conclu que le matériel génétique viral s’insérait dans le matériel génétique bactérien et y restait pendant plusieurs générations, transmis lors de la mitose. Dans ce cycle qu’elle a appelé « cycle lysogène », l’ADN du phage λ devenu endogène à l’ADN bactérien est appelé « prophage » et peut, après plusieurs générations, être excisé pour produire de nouveaux virus. Cette excision ne se déroule pas toujours correctement et du matériel génétique bactérien peut être intégré par erreur dans les nouveaux phages.

Esther Lederberg dans son laboratoire
Esther Lab.jpg, auteure Esther M. Zimmer Lederberg, source originelle http://www.estherlederberg.com/ColleaguesIndex.html, Redistribution, derivative work, commercial use, and all other use is permitted., https://commons.wikimedia.org/wiki/File:Esther_Lab.jpg
Bactériophage observé au microscope électronique à transmission
Phage S-PM2.png, Image: Hans-Wolfgang Ackermann, via Wikimédia Commons, CC-BY-2.5, https://commons.wikimedia.org/wiki/File:Phage_S-PM2.png
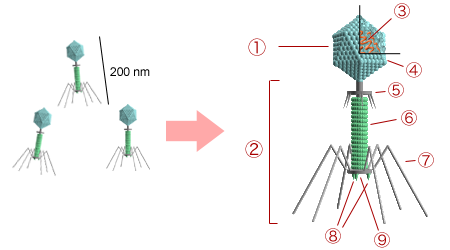
Structure d’un bactériophage
Bacteriophage structure.png, Fiche de Y_tambe, via Wikimédia Commons, GFDL, CC-by-sa, CC-BY-SA-3.0-migré, https://commons.wikimedia.org/wiki/File:Bacteriophage_structure.png
tête
queue
acide nucléique
capside
col
gaine contractile
fibres caudales
spicules
plaque terminale
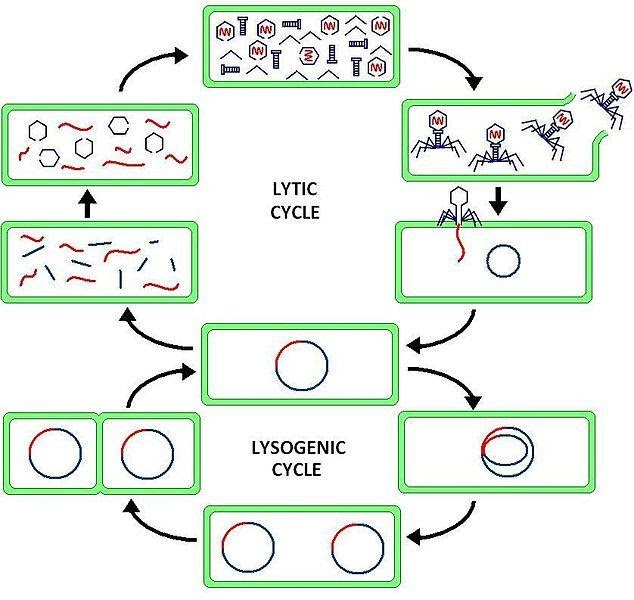
Cycles lytique et lysogène d’un bactériophage
Phage2.JPG, par Suly12, propre travail, CC-BY-SA-3.0-migrated, via Wikimédia Commons, https://commons.wikimedia.org/wiki/File:Phage2.JPG

Ainsi l’apparition de recombinant « LA22 his+ trp+ » dans le tube en U équipé d’un filtre pouvait s’expliquer de manière simple : lors d’un cycle, qu’il soit lytique ou lysogène, un bactériophage nouvellement formé peut par accident entraîner avec lui de l’ADN bactérien. Ce phage possède donc un génome modifié le rendant non virulent. Ainsi quand il se fixe sur une nouvelle bactérie, il intègre à celle-ci du matériel génétique bactérien, modifiant au passage son génome. On parle de Transduction.
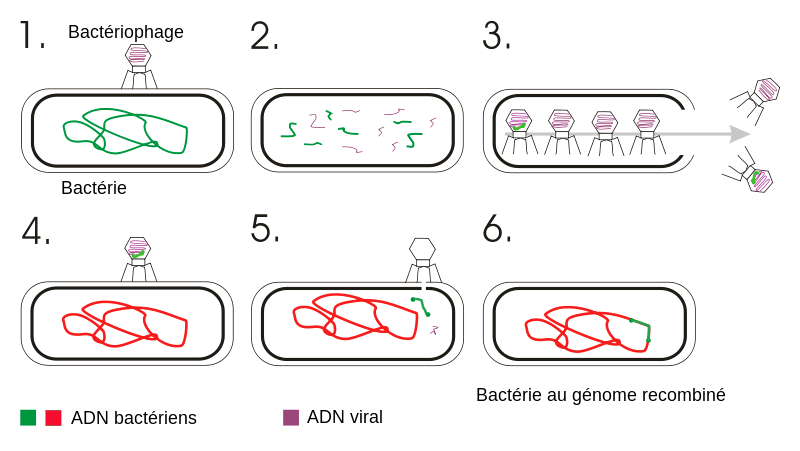
Mécanisme de transduction suite à un cycle lytique
Transduction génétique fr.svg, par Reytan avec modifications de Geni & toony, via Wikimédia Commons, domaine publique, https://commons.wikimedia.org/wiki/File:Transduction_genetic_fr.svg
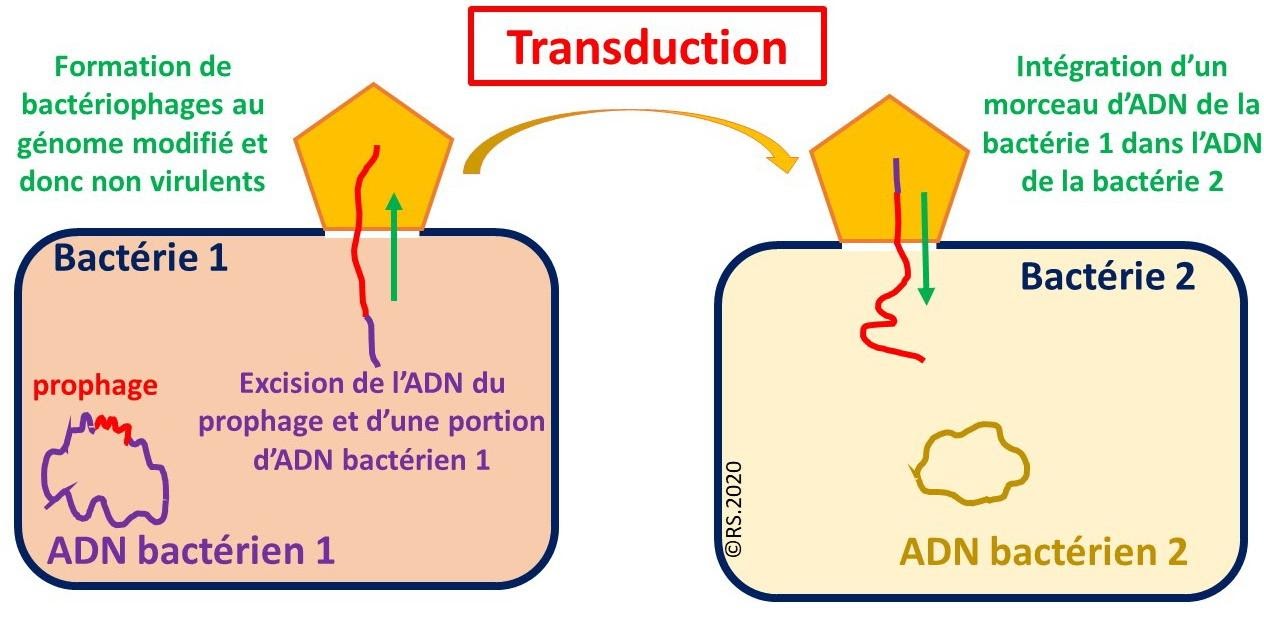
Mécanisme de transduction suite à un cycle lysogène
Transferts de gènes et complexification des génomes
Le transfert de gènes est un mécanisme beaucoup plus courant qu’on ne le pense. On en retrouve des traces aussi bien chez les procaryotes que chez les eucaryotes. En modifiant les génomes, il les complexifie et a même permis des avancées évolutives majeures.
Un exemple de complexification du génome due à une bactérie
Les algues du genre Porphyra constituent un élément de base dans la conception des sushis, aliment très prisé par les Japonais. D’après les écrits, cette algue est consommée depuis de nombreuses générations par les japonais.
Propriété
Or ces algues contiennent dans leur paroi, des glucides complexes : des agars, des carraghénanes et des porphyranes. Ces polysaccharides ne peuvent être dégradés (hydrolysés) que par des enzymes spécifiques (agarases, caraghénases et porphyranases) n’existant pas chez l’Homme mais courantes chez les bactéries marines Zobellia galactanivorans vivant sur ces algues et s’en nourrissant.
Les sushis étant consommés crus, l’hypothèse a été faite que des bactéries marines Zobellia galactanivorans aient été ingérées vivantes puis digérées ce qui aurait ainsi libéré leur l’ADN dans l’intestin des japonais consommateurs de sushis. Ainsi les bactéries de leur flore intestinale auraient subi un transfert de gènes et récupéré les séquences codant pour les enzymes digérant les sucres complexes des algues.

Maki Sushi
Maki Sushi Lunch sur plaque de feuille verte.jpg, par Janet Hudson via Wikimédia Commons, CC-BY-2.0, https://commons.wikimedia.org/wiki/File:Maki_Sushi_Lunch_on_green_leaf_plate.jpg
Montrer algues sèche de la cuisine
Pour vérifier cette hypothèse, deux équipes de chercheurs travaillant à la station biologique de Roscoff ont comparé les données génomiques de la flore intestinale de 5 individus japonais et de 18 individus nord-américains. En particulier, des gènes codant pour les porphyranases ont été recherchés dans certaines bactéries de la flore intestinale des deux populations, les bactéries Bacteroides plebeius. On précise que dans cette étude, la bactérie marine Zobellia galactanivorans n’est jamais retrouvée dans la flore intestinale des individus.

Résultats de la recherche de séquences nucléotidiques similaires à celles codant pour la porphyranase et l’agarase de Z. galactonivorans dans la flore intestinale de quelques individus
La comparaison des séquences trouvées chez des individus japonais avec la séquence du gène de la porphyranase ou celle du gène de l’agarase, montre, quand elles sont présentes, des pourcentages d’identité élevés. Les bactéries Bacteroides plebeius de leur flore intestinale possède donc bien dans leur génome l’une ou l’autre ou les 2 séquences codant pour ces enzymes.
Les sushis étant consommés crus, il est donc tout à fait envisageable que les bactéries marines aient été ingérées. Cependant comme aucune bactérie marine n’a été retrouvée vivante dans la flore intestinale, le transfert des gènes par conjugaison n’est pas envisageable et seule la transformation reste possible.
Ainsi lors de la digestion, de l’ADN de Zobellia galactanivorans aurait été libéré et aurait transformé les bactéries intestinales. Le microbiote a donc été modifié et comme le génome d’un individu est constitué de son génome propre et d’un génome associé (celui du microbiote), ainsi le génome des japonais a été complexifié.
Remarque
Il est cependant peu probable qu’un seul transfert de matériel génétique soit à l’origine de la modification du microbiote de toute une région du monde. On peut donc supposer que ce transfert soit régulier en raison de la consommation régulière des sushis.
Un exemple de complexification du génome due à un virus
Propriété
Les transferts interspécifiques peuvent se réaliser par le biais de vecteurs comme les virus. Certains virus sont spécialistes des procaryotes d’autres sont spécialistes des eucaryotes. Dans tous les cas, ils détournent la machinerie cellulaire à leur profit car ils sont incapables de se multiplier seuls, ne possédant pas le matériel nécessaire pour le faire.
Comme pour les bactériophages, l’ADN d’un virus d’eucaryote peut parfois s’intégrer à l’ADN de la cellule et rester dormant quelque temps. Il peut à ce moment-là devenir endogène c’est-à-dire intégrer définitivement le génome de l’organisme receveur.
Exemple
L’ADN humain contient 10 % d’ADN viral, le maïs en contient 50%.
Ce mécanisme peut expliquer l’apparition de caractères identiques chez plusieurs espèces n’appartenant pas aux mêmes branches évolutives. Il est possible dans l’étude de l’évolution des espèces de retracer les grands événements de transferts horizontaux de gènes.
La comparaison de séquences moléculaires homologues de plusieurs espèces permet de construire un arbre phylogénétique précisant les liens de parenté entre celles-ci. Plus 2 espèces présentent de similitudes au niveau de la séquence de molécules homologues, plus leurs liens de parenté sont étroits et plus elles partageront un ancêtre commun récent dont elles ont hérité cette molécule.
Quand des espèces situées sur des branches très éloignées présentent un caractère commun, on peut dire qu’il y a pas eu d’héritage commun ni de filiation entre ces espèces : il est donc tout à fait probable qu’un transfert de matériel ait été effectué chez ces différentes espèces.
Définition
Le gène introduit en provenance d’une autre lignée est qualifié de « xénologue ».
Définition
Deux séquences homologues de deux espèces différentes sont orthologues si elles descendent d'une séquence unique présente dans le dernier ancêtre commun aux deux espèces.
Sur le document suivant, les gènes A1 et A2 sont orthologues car ils résultent d’un évènement de spéciation. Cependant l’apparition récente du gène A2 chez l’espèce 1, indique qu’il y a eu transfert de ce gène depuis l’espèce 2. Ce gène A2 chez l’espèce 1 est qualifié d’exemplaire « xénologue ».
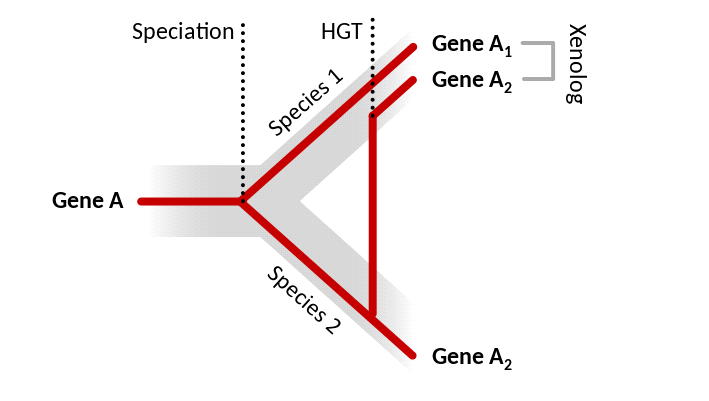
Apparition d’un gène xénologue
Xenology.svg, par Thomas Shafee, via Wikimédia Commons, Creative Commons Attribution-Share Alike 4.0 Internationalhttps://en.wikipedia.org/wiki/File:Xenology.svg
Exemple
On peut citer l’exemple des lectines. Ces protéines se fixant de manière spécifique et réversible sur les glucides sont aussi capables de se fixer sur les cristaux de glace en formation et jouent ainsi un rôle naturel d’antigel dans le cytoplasme des cellules.
On les trouve dans plusieurs lignées de poissons vivant dans des biotopes aux conditions physico-chimiques proches mais géographiquement éloignés comme le Hareng de l’Atlantique, l’Éperlan Japonais et l’Éperlan arc-en-ciel ou encore le corbeau des mers.

Hareng de l’Atlantique
Clupea harengus Gervais.jpg, par Gervais et Boulart, domaine public, via Wikimédia Commons, https://commons.wikimedia.org/wiki/File:Clupea_harengus_Gervais.jpg

Éperlans japonais
Hypomesus nipponensis - Musée national de la nature et des sciences, Tokyo - DSC06856.JPG, par Daderot propre travail , via Wikimédia Commons, CC-Zéro https://commons.wikimedia.org/wiki/File:Hypomesus_nipponensis_-_National_Museum_of_Nature_and_Science,_Tokyo_-_DSC06856.JPG
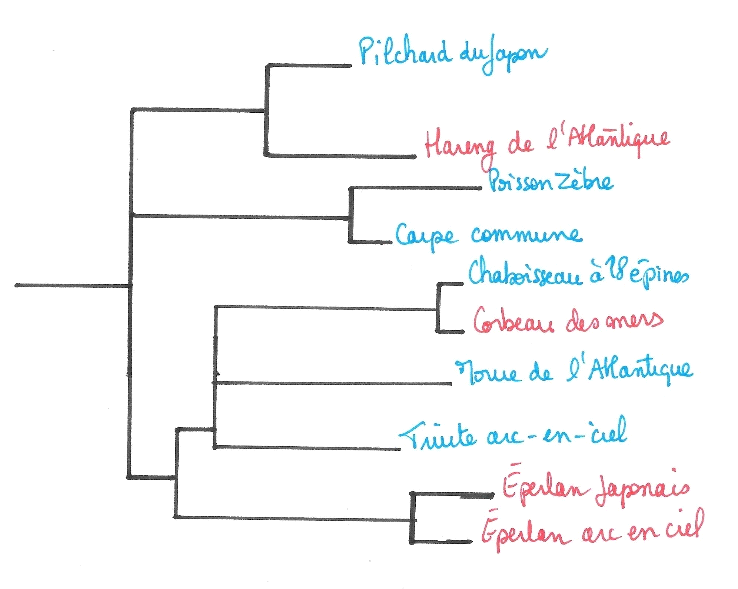
Arbre d’évolution de quelques poissons
©RS.2020
Les poissons dont les noms sont écrits en rouge sont détenteurs du gène responsable de la production des lectines.
Ces poissons étant situés sur des branches évolutives différentes, la thèse d’un vecteur viral est dans ce cas largement envisageable. On peut supposer qu’un individu Hareng de l’Atlantique (espèce la plus ancienne) ait acquis cette protéine suite à une mutation puis que le gène de celle-ci ait été transféré aux autres espèces génétiquement éloignées par le biais d’un virus.
Applications biotechnologiques des transferts horizontaux
Deux techniques exploitent les transferts horizontaux de gènes :
la transgénèse, qui permet de produire des êtres vivants possédant des gènes provenant d'une autre espèce et appelés OGM (organismes génétiquement modifiés)
la thérapie génique, qui permet de réparer, en général localement un génome défaillant (maladie génétique).
La transgénèse
Définition
La transgénèse est le fait d'incorporer un ou plusieurs gènes dans le génome d'un organisme vivant.
Dans certains cas, l'insertion du transgène se fait par l'intermédiaire d'un vecteur. Les vecteurs les plus connus sont les plasmides et ils peuvent comporter des séquences de régulation, de réplication ou encore des marqueurs de sélection. Les séquences de régulation comportent obligatoirement un promoteur adapté à l'organisme receveur. Les marqueurs de sélection sont généralement des gènes de résistances à des antibiotiques, des herbicides ou des pesticides.
L'introduction du transgène, ou du vecteur dans le génome de la cellule, peut se faire par perméabilisation des membranes, par un procédé mécanique (projection de microbilles de tungstène ou d'or portant le plasmide), ou encore par un vecteur biologique (une bactérie, Agrobacterium tumefaciens pour la transformation des plantes ou un phage pour la transformation des bactéries). Il est également possible d'introduire la construction génique directement, par micro-injection dans la cellule.
Exemple
L’expérience la plus connue de transgénèse est celle qui a consisté à insérer dans le génome de la souris un gène de méduse responsable de la production d’une protéine GFP impliqué dans la bioluminescence.
Ce mécanisme s’apparente à la transformation chez les bactéries. Cependant vu que cette action modifie fortement le phénotype des cellules eucaryotes animales on utilisera plutôt le terme de « transfection ».
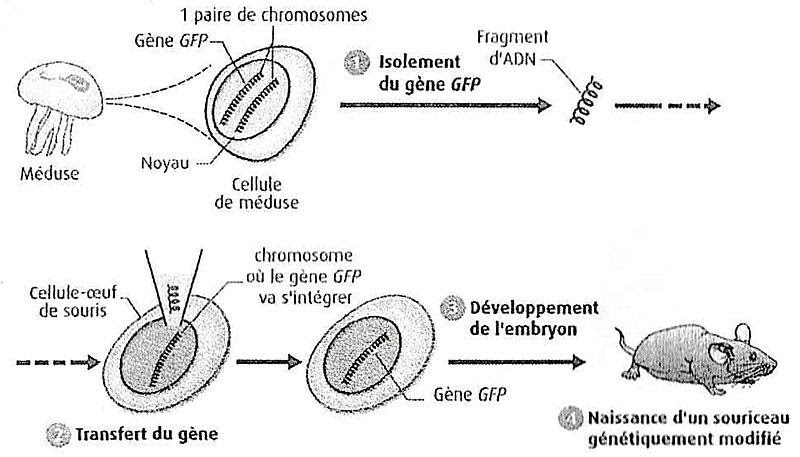
Expérience de transgénèse
Schéma de transgénèse.jpg par Pradana Aumars via Wikimédia Commons, CC-BY-SA-4.0, https://commons.wikimedia.org/wiki/File:Sch%C3%A9ma_de_transg%C3%A9n%C3%A8se.jpg?uselang=fr

Souris exprimant la protéine GFP
GFP Mice 01.jpg, par see above via Wikimédia commons, source Ingrid Moen, Charlotte Jevne, Jian Wang, Karl-Henning Kalland, Martha Chekenya, Lars A Akslen, Linda Sleire, Per Ø Enger, Rolf K Reed, Anne M Øyan and Linda EB Stuhr: Gene expression in tumor cells and stroma in dsRed 4T1 tumors in eGFP-expressing mice with and without enhanced oxygenation. In: BMC Cancer. 2012, 12:21. doi:10.1186/1471-2407-12-21 PDF, CC-BY-2.0, https://commons.wikimedia.org/wiki/File:GFP_Mice_01.jpg?uselang=fr
Les applications de la transgénèse aujourd’hui sont essentiellement médicales.
Exemple
On peut citer l’exemple de la production d’insuline dans le cadre du traitement du diabète de type 1 (insulino-dépendant).
Les personnes atteintes de diabète de type 1 présentent une déficience en cette hormone polypeptidique hypoglycémiante. Cette déficience est due à une destruction des cellules du pancréas assurant sa production. Sans insuline, le taux de sucre dans le sang (la glycémie) devient supérieur à la valeur dite « consigne » qui est de 1g par litre.
Historiquement, l’insuline utilisée pour soigner les malades a d’abord été extraite de pancréas de porc et de bœuf. La demande de plus en plus importante d’insuline au niveau mondial et le risque sanitaire associé à l’utilisation de produits animaux ont conduit à mettre en place des techniques de production d’insuline par génie génétique. Des bactéries ont été transformées pour produire de l’insuline.
Pour cela les chercheurs ont modifié un plasmide en y introduisant le gène codant pour le précurseur de l’insuline (la proinsuline). Ils ont ensuite transformé des bactéries par ce plasmide recombiné pour en faire des bactéries productrices de proinsuline.

Plasmide utilisé pour produire un plasmide recombiné
PBR322.svg par Ayacop (+ Yikrazuul ) via Wikimédia Commons, domaine publique, modifié par Sandra Rivière, https://commons.wikimedia.org/wiki/File:PBR322.svg
Propriété
Ce plasmide possède deux gènes de résistance à deux antibiotiques : le gène A confère à la bactérie qui le possède, une résistance à l’ampicilline et le gène T confère une résistance à la tétracycline.
Pour introduire un gène dans un plasmide, et donc dans une molécule d’ADN, il faut utiliser une enzyme dite « de restriction ». Cette dernière est capable de couper l’ADN au niveau d’une séquence de nucléotides caractéristique appelée « site de restriction ». L’enzyme choisie ici est l’enzyme BamH I dont le site de restriction se situe au sein du gène T.
Dans un tube à essais, on introduit une solution contenant des plasmides originaux, une solution d’enzymes de restriction BamH I, une solution contenant le gène de proinsuline et une solution d’enzyme de type ligase. On porte le tout à 38°C et on laisse incuber. Si la recombinaison fonctionne, le plasmide aura été modifié et le gène T sera inactif car non continu. Les bactéries transformées par ce plasmide recombiné seront résistantes à l’ampicilline mais pas à la tétracycline.
Si la recombinaison ne fonctionne pas le gène T restera continu et sera fonctionnel : le plasmide n’aura pas été modifié. Des bactéries ayant été transformées par ce plasmide seront résistantes aux deux antibiotiques.
Il peut apparaître dans le milieu des gènes de proinsuline circularisés qui ne pourront pas transformer une bactérie.
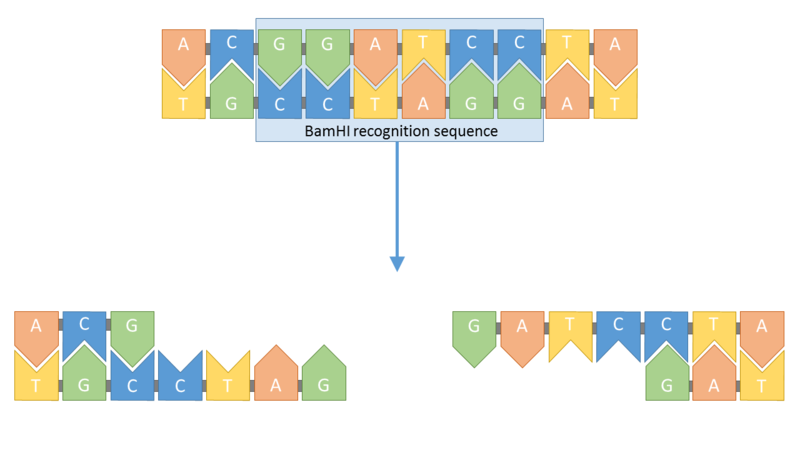
Site de restriction de l’enzyme BamH I
BamHI2.png, par Simon Caulton, Propre travail, Creative Commons Attribution-Share Alike 4.0 International . https://en.wikipedia.org/wiki/File:BamHI2.png
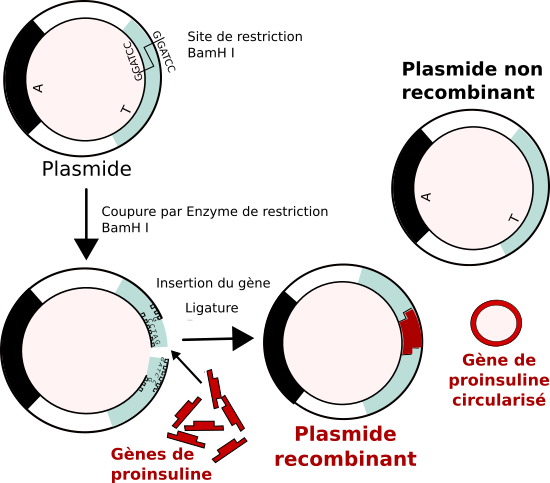
Étapes de la recombinaison d’un plasmide
Formation recombinante de plasmids.svg, par Soupe minestrone sur Wikipédia anglais, via Wikimédia Commons, CC-BY-SA-3.0-migré modifié par Sandra Rivière, https://commons.wikimedia.org/wiki/File:Recombinant_formation_of_plasmids.svg
Pour obtenir des bactéries recombinées, on utilise la capacité de transformation des bactéries. Pour cela, il suffit d’introduire le contenu du tube de recombinaison dans un milieu de culture liquide contenant une souche bactérienne Escherichia coli sensible aux 2 antibiotiques. Ainsi au sein de cette population bactérienne, des bactéries vont intégrer un des 2 types de plasmides obtenus.
Les gènes de résistance sont donc pratiques car ils vont permettre la sélection des bactéries ayant récupéré le gène de la proinsuline. En effet, il est matériellement impossible de « voir » le gène et donc de sélectionner les plasmides qui ont bien été recombinés. C’est donc l’absence ou la présence de bactéries face aux antibiotiques qui nous permettra de déduire la présence de tel ou tel plasmide.
Les bactéries étaient initialement sensibles aux deux antibiotiques mais elles ont été transformées par l’un des deux plasmides : elles sont donc au moins résistantes à l’ampicilline car les 2 plasmides possède le gène A fonctionnel. En cultivant ces bactéries soumises aux différents plasmides sur un milieu contenant de l’ampicilline, les bactéries non transformées vont être éliminées.
On aura donc récupéré uniquement des bactéries transformées. Il conviendra alors d’isoler les bactéries transformées par le plasmide recombiné, c'est-à-dire d’isoler les bactéries résistantes à l’ampicilline mais sensibles à la tétracycline.
Ainsi sur un milieu de culture contenant les 2 antibiotiques, seules les bactéries ayant reçu le plasmide non recombiné survivront. Celles ayant reçu le plasmide recombiné mourront. On peut alors se demander comment les récupérer si elles sont lysées par l’antibiotique.
La technique est simple : à partir de la culture sur milieu enrichi en ampicilline, il convient de faire à l’aide d’un tampon, une empreinte de cette culture et de la déposer sur le milieu contenant les 2 antibiotiques. La comparaison des résultats obtenus permettra d’identifier dans la première culture, les colonies de bactéries transformées par le plasmide recombinés : ce seront les colonies qui resteront présentes sur le milieu enrichi en ampicilline mais ayant disparu sur le milieu contenant les 2 antibiotiques.
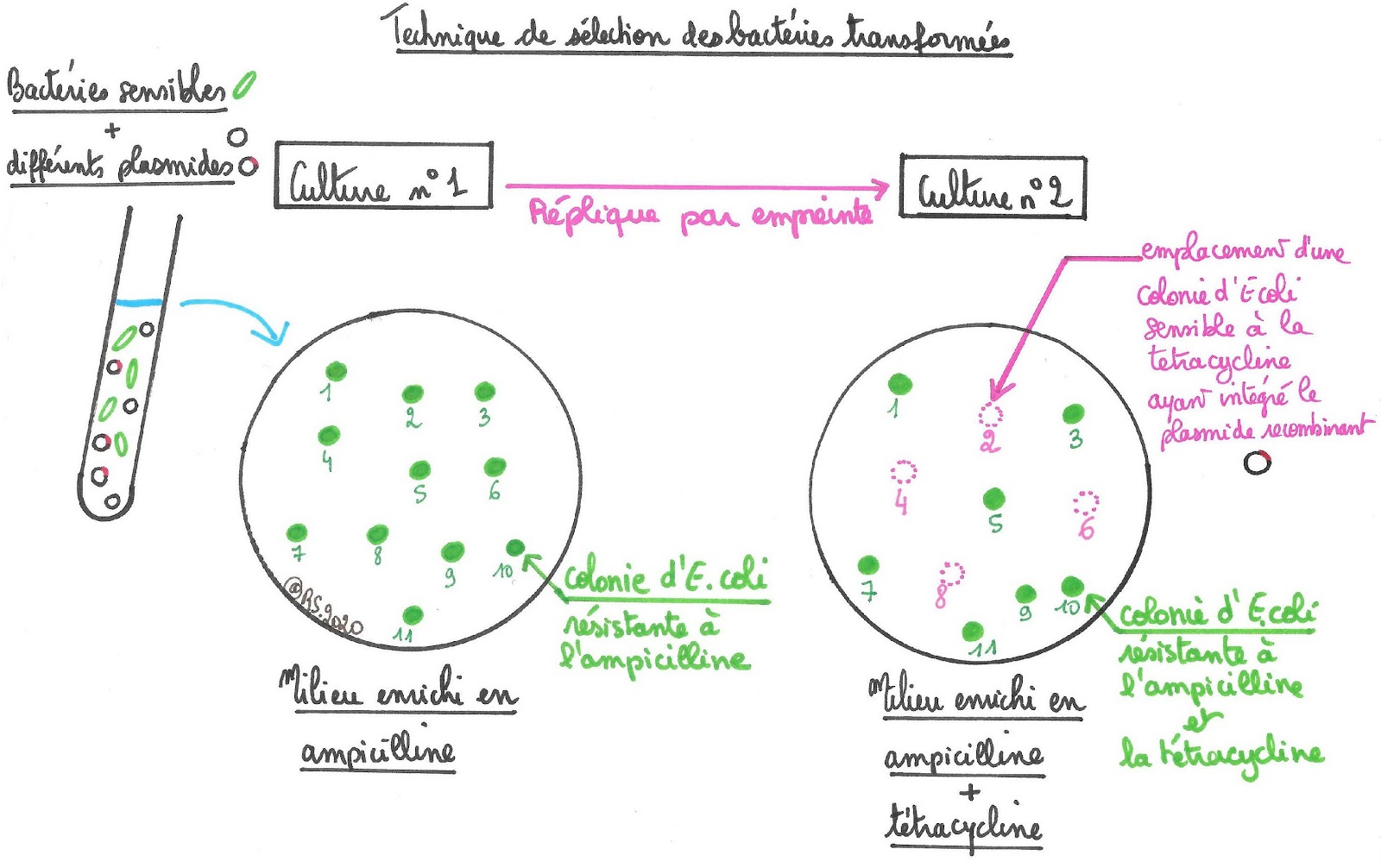
Sélection des bactéries transformées par le plasmide recombiné
Il suffira ensuite de prélever ces colonies sur le milieu 1 et de les cultiver sur un milieu gélosé nutritif complet pour pouvoir récupérer ensuite le précurseur d’insuline.
Pour ce faire, il suffira de lyser les bactéries productrices pour libérer le précurseur d’insuline.
En effet celui-ci se trouve dans le cytoplasme des bactéries et ces dernières ne l’excrètent pas dans le milieu. Cependant c’est un précurseur qui est produit et non de l’insuline. Il faut donc lui faire subir une action enzymatique pour le transformer en insuline injectable. Ainsi dans un contenant de laboratoire, le précurseur de proinsuline constitué de 86 acides aminés est soumis à l’action de différentes enzymes. On obtient de l’insuline mature (51 acides aminés), un peptide C (31 acides aminés) et 4 acides aminés libres. Or l’objectif est de récupérer une solution d’insuline pure, il va donc falloir la séparer des autres produits issus des réactions enzymatiques.
On utilise un procédé de séparation très simple : la chromatographie par gel-filtration. Dans une colonne de filtration, on dispose des billes de gel possédant des pores de diamètre sélectionné. Lors de la filtration, les molécules dont le volume correspond aux pores seront piégées par les billes et les molécules plus grosses circuleront dans la colonne et seront récupérables dans le filtrat. On parle de filtration par exclusion.
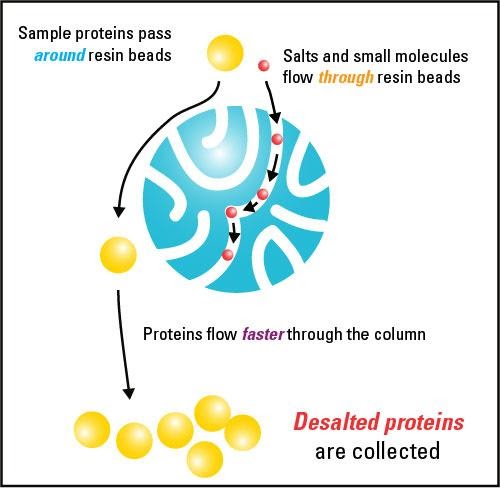
Principe de filtration par exclusion sur colonne de gel-filtration
dessalage d'échantillons par chromatographie par filtration sur gel.jpg, par Potcherboy, propre travail, via wikimédia commons, modifié par Sandra Rivière, CC-BY-SA-3.0, https://commons.wikimedia.org/wiki/File:Sample_desalting_using_gel_filtration_chromatography.jpg
Ici on cherche à éliminer les petites molécules à savoir le peptide C et les acides aminées afin de récupérer l’insuline. Il va donc falloir procéder à 2 filtrations consécutives : une pour éliminer les acides aminées libres et une pour éliminer le peptide C.
Première filtration : Sachant qu’un acide aminé a une masse moléculaire d’environ 100 Daltons (1 Da = moitié de la masse d’un atome de carbone 12), on va installer des billes dont les pores peuvent accueillir un acide aminé. Ces derniers seront donc piégés dans les billes de gel et les molécules plus grosses circuleront et seront récupérées dans le filtrat, à savoir peptide C et insuline.
Deuxième filtration : on utilise cette fois des billes de gel dont les pores peuvent accueillir le peptide C mais pas l’insuline. Le peptide C est constitué de 31 acides aminés : il a donc un volume de 3100 Da. L’insuline est constituée de 51 acides aminés soit un volume d’environ 51 x 100 = 5100 Da. Les billes de gel devront donc présenter des pores inférieure à 5100 Da afin de piéger le peptide C mais pas l’insuline. Le dernier filtrat correspondra donc à une solution pure d’insuline.
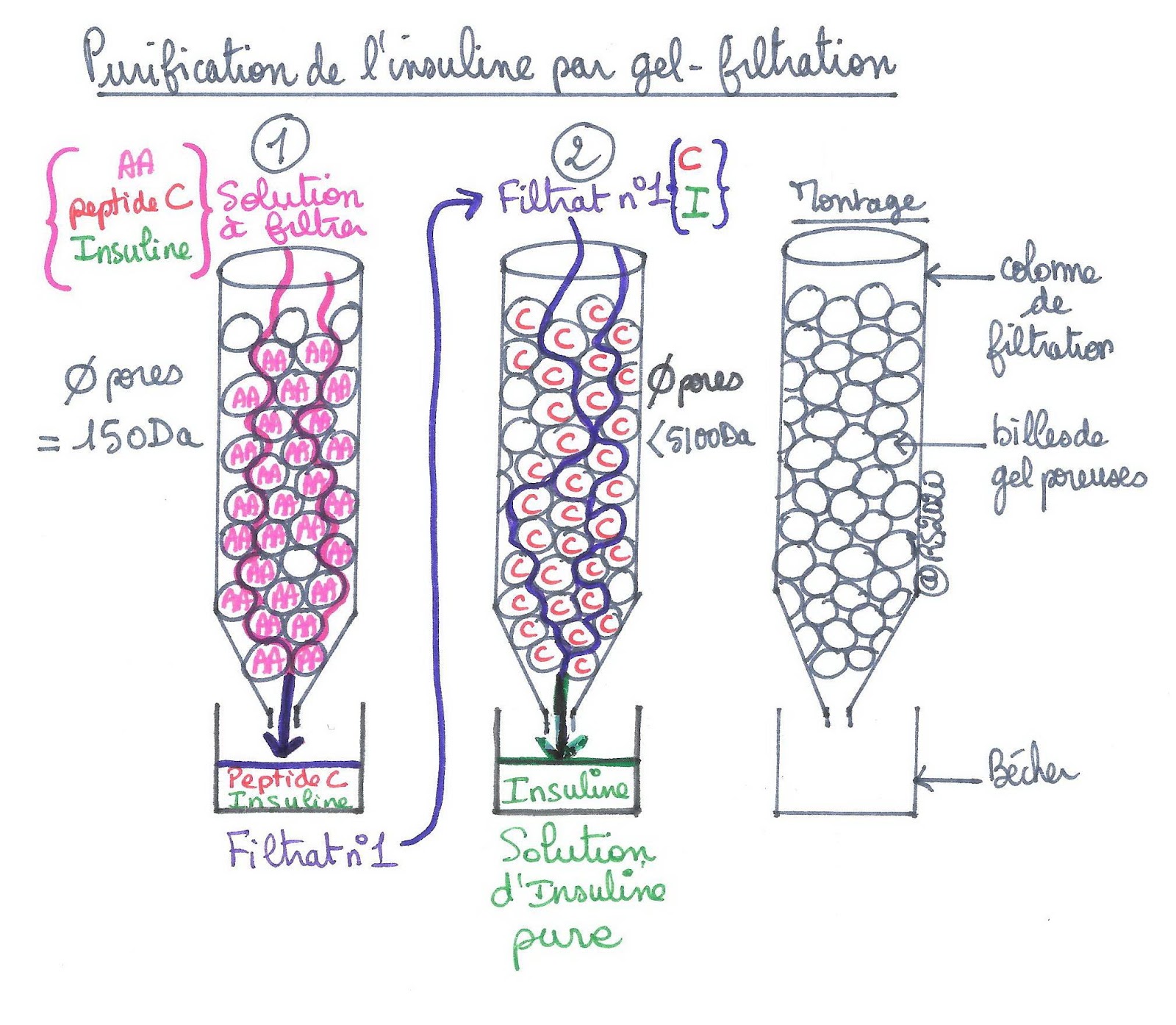
Filtration de l’insuline par exclusion sur colonne de gel-filtration
La thérapie génique
Définition
La thérapie génique ou génothérapie est une stratégie thérapeutique qui consiste à faire pénétrer des gènes dans les cellules ou les tissus d'un individu pour traiter une maladie. La thérapie génique vise à remplacer ou complémenter un allèle mutant défectueux par un allèle fonctionnel ou à surexprimer une protéine dont l'activité aurait un impact thérapeutique.
Propriété
L'utilisation de virus modifiés pour transporter un gène thérapeutique repose sur le constat de l'efficacité des virus pour transférer leur propre matériel génétique dans les cellules humaines.
Pour produire des vecteurs viraux, on utilise des virus modifiés génétiquement, dits sécurisés. Le principe consiste à éliminer les séquences du virus qui codent des protéines, notamment celles associées à un éventuel comportement pathogène du virus, et à ne conserver que celles qui sont utilisées pour construire la particule virale et assurer le cycle d'infection. Le génome du virus est reconstruit pour porter les séquences du gène thérapeutique.
Ce sont principalement les rétrovirus qui sont utilisés comme vecteur en thérapie génique car ils permettent d'insérer la nouvelle information génétique dans le génome de la cellule cible.
Définition
Un rétrovirus est un virus à ARN qui possède une enzyme capable de rétrotranscrire l’ARN en ADN afin de faciliter son insertion dans l’ADN cellulaire.
Propriété
Une fois intégré, le génome du rétrovirus sous sa forme ADN est stable et transmis de manière mendélienne comme n'importe quel gène de la cellule.
Si la plupart des essais cliniques ont été réalisés avec des vecteurs dérivés de rétrovirus de souris, certains essais cliniques sont actuellement en cours utilisant des vecteurs dérivés du virus VIH.
Exemple
Dans les années 1990, les chercheurs ont essayé de réaliser la thérapie avec des Adénovirus. Ce sont des virus qui possèdent de l’ADN et non de l’ARN. Contrairement aux rétrovirus qui sont obligés d’attendre la mitose pour intégrer leur matériel génétique, les adénovirus peuvent le faire directement. Cependant les chercheurs ont eu du mal à se débarrasser complètement des gènes les rendant potentiellement infectieux. Ils sont donc aujourd’hui laissés de côté au profit des rétrovirus.
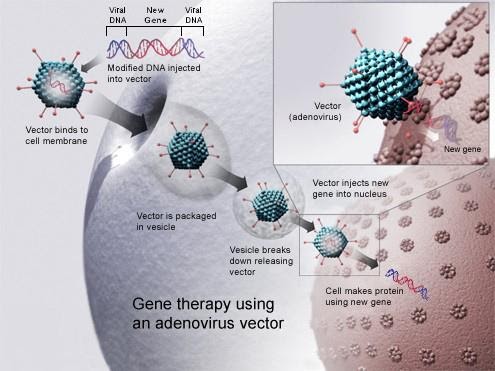
Principe de la thérapie génique
Gene therapy.jpg, par National Institutes of Health, via Wikimédia Commons, domaine publique, https://commons.wikimedia.org/wiki/File:Gene_therapy.jpg

Actuellement de nombreux essais sont réalisés dans le monde et l’accent est particulièrement mis sur les cancers, les maladies cardiovasculaires et les maladies monogéniques comme la mucoviscidose.
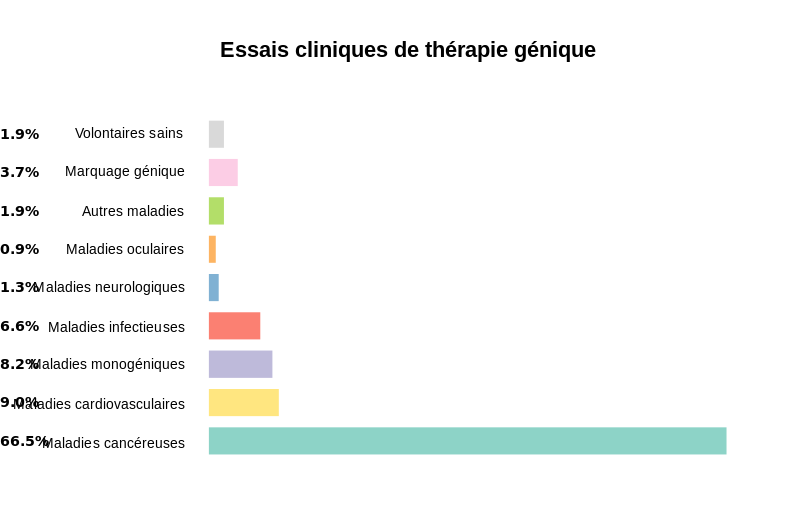
Essais cliniques de thérapie génique
Essais cliniques de thérapie génique.svg, par Shakki, propre travail, via Wikimedia commons, CC-BY-SA-3.0, https://commons.wikimedia.org/wiki/File:Essais_cliniques_de_th%C3%A9rapie_g%C3%A9nique.svg
Revenir au chapitre
Commentaires





