Cours
Interaction lumière-matière



Avec :
est la constante de Planck,
est en Joule ().
L’étude des spectres de raies a permis aux physiciens de comprendre l’interaction lumière-matière.
Émission de lumière par un atome :
, l’atome perd donc de l’énergie en émettant un photon.
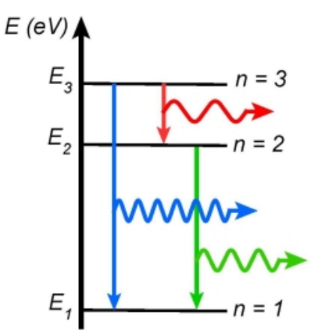
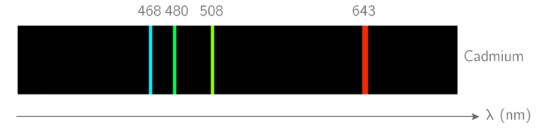
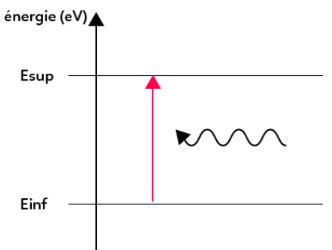
Absorption de lumière par un atome :
: l’atome gagne donc de l’énergie en absorbant un photon.
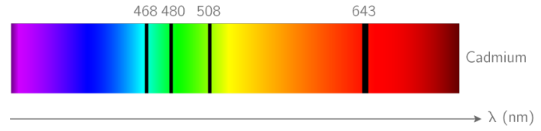

Attention : l’énergie des atomes est donnée en (électron-volt) car le joule est trop grand. Il faudra faire une conversion puisque dans les formules, l’énergie est toujours donnée en joule.