

Tableau d'avancement
Le tableau d'avancement
Avancement d'une réaction chimique
Définition
L’avancement d’une réaction, noté , est une grandeur exprimée en mole qui permet de rendre compte de l’évolution des quantités de matière des espèces au sein d’un système chimique au cours du temps.
Exemple
La réaction entre le méthane et le dioxygène donne :
Ce qui signifie que pour une molécule de méthane (), 2 molécules de dioxygène réagissent.
On peut donc généraliser en disant que 1x mol de réagissent avec 2x mol de pour former 1x mol de et 2x mol de .
Le tableau
Définition
Le tableau d’avancement décrit l’évolution des quantités de matière d’un système chimique de l’état initial à l’état final, en fonction de l’avancement .
Propriété
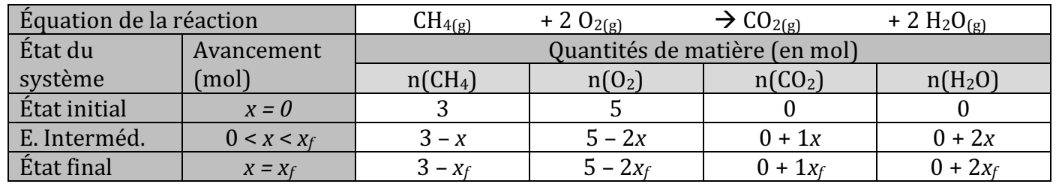
Le système chimique va logiquement évoluer depuis un état initial où vers un état final pour lequel .
Les quantités de matière des réactifs vont diminuer (puisqu’ils sont consommés) tandis que celles des produits vont augmenter (puisqu’ils sont formés).
Exemple
Exemple pour la réaction entre et avec 3 mol de et 5 mol de
Transformations totales et non totales
Définition
L’avancement maximal correspond à la plus petite valeur de l’avancement pour laquelle la quantité finale d’au moins un des réactifs est nulle.
Ce réactif est le réactif limitant.
Remarque
Si on prenait la plus grande valeur, on aurait pour l’autre réactif des quantités de matière négatives, ce qui est impossible.
Exemple
En reprenant la réaction de la partie 1 :
Si est le limitant, alors donc
Si est le limitant, alors donc
Le réactif limitant est donc .
Définition
Si l’avancement final est égal à l’avancement maximal, , alors la transformation est totale.
Propriété
Lorsqu’on connait l’avancement final, on peut réaliser un bilan de matière, c’est-à-dire calculer les quantités de matière pour chaque espèce chimique à la fin de la réaction.
Exemple
En reprenant toujours le même exemple de la partie I :

Pour une transformation non-totale, il faudra connaitre la valeur de l’avancement final (par titrage) pour effectuer le bilan de matière à l’état final.
Les mélanges stœchiométriques
Définition
Soit la réaction d’équation :
Un mélange initial est dit stœchiométrique si les quantités initiales des réactifs sont dans les mêmes proportions que les nombres stœchiométriques, c’est-à-dire que les réactifs sont tous limitants, soit :
Exemple
Pour et :
Si est le limitant, alors donc
Si est le limitant, alors donc
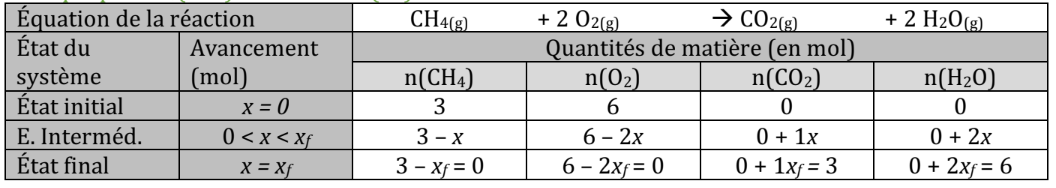
Les quantités finales des réactifs sont nulles pour le même avancement, donc , les deux réactifs sont limitants, c’est un mélange stœchiométrique.
Propriété
Dans le cas d’une transformation non totale, on ne peut conclure sur l’état final d’un mélange initial stœchiométrique.
Dans le cas d’une transformation totale pour un mélange initial stœchiométrique, les quantités finales de réactifs sont nulles.
Seuls les produits de la réaction et les éventuelles espèces spectatrices sont présents à l’état final.
Exemple
Voilà un exemple de tableau d'avancement avec et :
Commentaires
Dilhan
3
Il y a une faute lors de l'exemple de l'avancement maximale ce n'est pas
Dilhan
2
0-2*2,5 mais 0+2*2,5
Kai_sensei95
-1
vrai merci





