

Réactions d'oxydo-réduction
Les oxydants et les réducteurs
Définition
Une réaction d’oxydo-réduction met en jeu des transferts d’électrons entre un oxydant et un réducteur.
Un oxydant, noté Ox, est une entité chimique capable de capter un ou plusieurs électrons.
Un réducteur, noté Red, est une entité chimique capable de céder un ou plusieurs électrons.
Définition
Les oxydants et les réducteurs ne sont pas seuls, ils sont en couple.
Un oxydant et un réducteur sont dits conjugués et forment alors un couple oxydant/réducteur, noté , s’ils peuvent être reliés
par une demi-équation électronique telle que :
Le nombre d’électrons est noté .
Exemple
Le couple donne la demi-équation électronique :
Le couple donne la demi-équation électronique :
Définition
Le passage de l’oxydant à son réducteur conjugué est une réduction.
Le passage du réducteur à son oxydant conjugué est une oxydation.
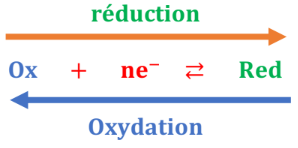
On dit que l’oxydant est réduit en son réducteur conjugué tandis que le réducteur est oxydé en son oxydant conjugué.
Exemple
Oxydation de l’Aluminium :
Réduction du Zinc II :
Remarque
Pour les cas simples comme les métaux, la demi-équation électronique se fait en une seule étape.
Pour les cas plus complexes, il est nécessaire de faire trois étapes.
Exemple
Prenons l’exemple avec le couple :
Etape 1 : on écrit les deux espèces conjuguées et on équilibre les éléments autres que et :
Étape 2 : on équilibre les oxygènes avec un ajout d’eau () :
Étape 3 : on équilibre les hydrogènes avec un ajout d’ion :
Étape 4 : on équilibre les charges avec des électrons (ici on a 6 charges positives de part et d'autre) :
Les états physiques doivent être précisés, on a donc :
Les réactions d’oxydoréduction
Définition
Une réaction d’oxydo-réduction est la réaction entre l’oxydant d’un couple et le réducteur d’un autre couple.
Le réducteur en présence va transférer des électrons à l’oxydant.

L’équation d’oxydo-réduction est faite en combinant les deux demi-équations des couples.
Dans l’équation d’oxydo-réduction, il ne doit plus y avoir d’électrons, pour cela il faudra faire en sorte que les électrons échangés soient égaux en nombre dans les deux demi-équations.
Exemple
Exemple de la réaction entre les ions et les atomes des couples et :
Étape 1 : on écrit les deux demi-équations avec les réactifs à gauche :
Oups, cette equation ne s'affiche pas correctement...
Étape 2 : on combine les demi-équations de telle sorte que le nombre d’électrons cédés soit le même que celui d’électrons captés :
Étape 3 : on enlève les électrons de l’équations puisqu’il y en a autant en réactifs et en produits :

Ici le cuivre métallique a réagi avec les ions argent pour donner les ions (bleus en solution aqueuse) et un dépôt d’argent métallique (gris).
Commentaires
Suna14
0
Je ne comprends toujours pas comment on sait qui est l'oxydant ou le réducteur
HawaM9
0
Pour reconnaître l'oxydant il ne faut pas oublier que les électrons ne- sont toujours de son côté et non du côté du réducteur et pour ce qui est du réducteur il est toujours isolé après le = qui veut dire que le transfère peut se faire dans les deux sens.
HawaM9
-2
Réponds...
0r1an0ui11e_
0
Il faut regarder le couple qu'on te donnedans l'énoncé de ton exercice. C'ets Par exemple
0r1an0ui11e_
3
c'est toujours présenté sous la forme OxRed, oxydant a gauche, réducteur à droite
94__l
1
Comment on sait le nombre d’électron a ajouter dans l’équat
Baptiste_Hba
-1
Il me semble qu'il y a une faute : Ag + 1e- donne Ag- et non Ag+
BLOUIN
0
Non non il s'agit bien de Ag+
J'ai fais cette expérience en classe.
Mysterious_M
1
Dans la remarque, tu dis qu'il ne faut faire que trois étapes alors que tu en fais 4 ! Sinon j'ai tout compris, même si la faute dans la demi-équation m'a déroutée...





