

Cohésion de la matière solide
Cohésion des solides
Solides ioniques
Définition
Les ions peuvent être assimilés à des sphères chargées positivement (cations) ou négativement (anions).
Ils peuvent former des solides ioniques par association d’un anion et d’un cation, puisque cation et cations se repoussent, tout comme anions et anions.
Un solide ionique est électriquement neutre.
Exemple
Pour le chlorure de sodium, il y a un anion chlorure de charge et un cation sodium de charge .
Les ions chlorure vont être attirés par les ions sodium, et réciproquement.
On aura donc un solide ionique (le positif en premier).

Cette formule est appelée formule statistique. Elle indique les ions présents et en quelles proportions.
Propriété
Asservi à la force électrostatique, chaque ion s’entoure d’ions de signes opposés et forme un cristal ionique. C’est cette interaction électrostatique qui assure la cohésion du solide ionique.
Théorème
Dans un solide ionique, les ions sont immobiles et ont des positions déterminées.
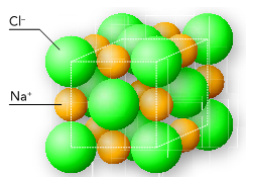
Représentation d'un solide ionique de type "NaCl"
Solides moléculaires
Propriété
Un solide moléculaire est constitué de molécules régulièrement disposées dans l’espace et qui sont statiques.
Les molécules sont généralement disposées de telle sorte que les moments dipolaires soient alignés, c’est à dire que les pôles électriques de signe opposés soient les plus proches.

La cohésion des solides moléculaires est assurée par deux types d’interactions intermoléculaires :
les interactions de Van der Waals
les liaisons hydrogènes
Définition
Les interactions de Van der Waals sont des interactions entre dipôles électriques.
Propriété
Pour les molécules polaires, le pôle positif va être au plus proche du pôle négatif d’une autre molécule.
Ainsi les moments dipolaires sont alignés. Les interactions électrostatiques entre les dipôles permanents assurent la cohésion du solide.
Propriété
Pour une molécule apolaire, il n’y a pas de moment dipolaire, il n’y aura donc pas d’interaction électrostatique permanente entre les dipôles.
Néanmoins, à un moment donné, les électrons vont se retrouver davantage autour d’un des atomes et créer un dipôle instantané.
Ces dipôles instantanés vont interagir et assurer la cohésion du solide, de manière permanente.
Définition
Les liaisons hydrogène se forment entre un atome d’hydrogène lié à un atome très électronégatif, et un autre atome (également très électronégatif) portant un doublet non liant.
C’est donc une liaison entre un hydrogène et un doublet non-liant. Les atomes concernés sont essentiellement , , , et .
Les trois atomes liés par une liaison hydrogène sont alignés.
La liaison hydrogène est généralement représentée par un trait discontinu entre l’hydrogène et le doublet non liant.
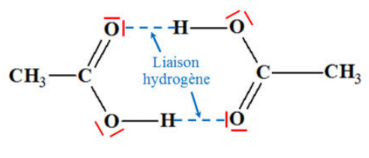
Propriété
Toute molécule possédant un groupe (au moins) va faire des liaisons hydrogène.
Solubilité d'une espèce chimique
Nature du solvant
Définition
Un solvant constitué de molécules polaires est un solvant polaire.
Exemple
L'eau, l’ammoniac, l’éthanol, etc.
Définition
Un solvant constitué de molécules apolaires est un solvant apolaire.
Exemple
Le tétrachlorométhane, le cyclohexane, etc.
Solubilité d’un soluté dans un solvant
Propriété
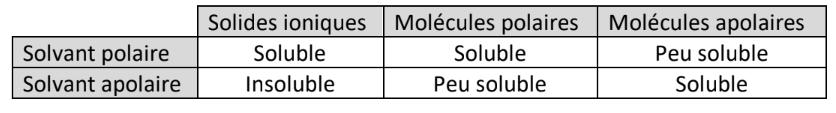
Un soluté est soluble dans un solvant si les interactions entre les entités (molécules, ions) du soluté sont de même nature que celles qui s’exercent entre les molécules de solvant.
Propriété
Les solides ioniques sont solubles dans les solvants polaires ; ils sont donc solubles dans l’eau.
Cette dissolution s’explique par l’établissement d’interaction électrostatiques entre les molécules de solvant et les ions du solide.
Exemple
Le sel dans l’eau.
Propriété
Les solutés moléculaires polaires sont généralement solubles dans les solvants polaires.
Exemple
Le sucre dans l’eau.
Propriété
Les solutés moléculaires apolaires sont généralement solubles dans les solvants apolaires.
Exemple
le diiode apolaire soluble dans le cyclohexane apolaire.

Le tableau ci-dessous récapitule l'ensemble des propriétés vues plus haut :
Dissolution d’un solide ionique dans l’eau
Définition
La dissolution se fait en 3 étapes successives :
Dissociation des ions du solide
Solvatation des ions
Dispersion des ions.
Remarque
Les solides ioniques sont très solubles dans les solvants polaires.
La solvatation dans l’eau est appelée hydratation.

Etape 1 : dissociation du solide ionique
Un solide ionique, placé dans un solvant polaire va s’entourer des molécules du solvant.
Les cations du solide vont être attirés par le pole négatif de la molécule, les anions par le pôle positif.
Les interactions entre le solvant et les ions vont faire diminuer les forces attractives entre les ions dans le solide : les anions et cations se dissocient du solide ionique.

Etape 2 : solvatation des ions
Chaque ion va s’entourer de molécules de solvant présentant le pôle opposé à la charge de l’ion. Ils sont solvatés.

Etape 3 : dispersion des ions
Sous l’effet de l’agitation thermique, les ions s’éloignent du solide ionique et se répartissent dans toute la solution ; ils se dispersent.
Définition
La dissolution d’un solide ionique dans l’eau est modélisée par une équation de réaction de dissolution qui doit respecter la conservation des éléments chimiques et de la charge électrique.
Pour un solide ionique de formule constitué des ions et , cette équation s’écrit :
Exemple
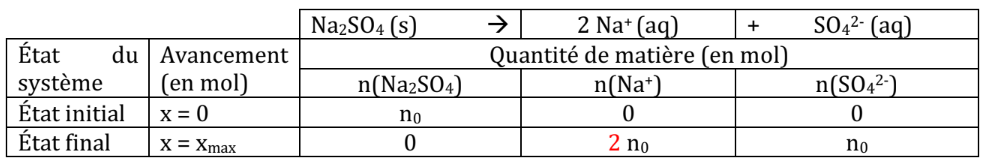
Prenons l'exemple de la dissolution du sulfate de sodium :
Définition
La concentration en quantité de matière des ions en solution et est notée et . Soit :
Où et s'expriment en .
Propriété
La concentration en quantité de matière des ions est reliée à quantité de solide à dissoudre.
Cette relation peut être déterminée à l’aide d’un tableau d’avancement (voir chapitre 3).
Exemple
Prenons l'exemple du Sulfate de sodium :
Le savon : un solide ionique particulier
Définition
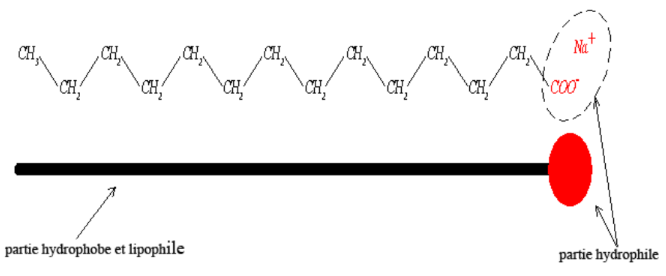
Un savon est un mélange de carboxylates de sodium (ou de potassium) de formule .
est une chaîne carbonée non ramifiée possédant plus de atomes de carbone.
Définition
Les ions carboxylates présents dans les savons possèdent une extrémité hydrophile (et lipophobe) et une extrémité lipophile (et hydrophobe) : ce sont des espèces amphiphiles.
On les appelle aussi tensioactifs.
Les savons sont faiblement solubles dans l’eau, en présence d’alcool leur solubilité augmente.
On remarque alors que le groupe carboxylate est négatif et s’entoure facilement de molécules d’eau.
Propriété
Les salissures peuvent être de nature :
Minérale (terre, rouille) et interagissent avec la partie polaire de la molécule
Organique (graisses, huiles) et interagissent avec la partie apolaire de la molécule
Extraction par solvant
Définition
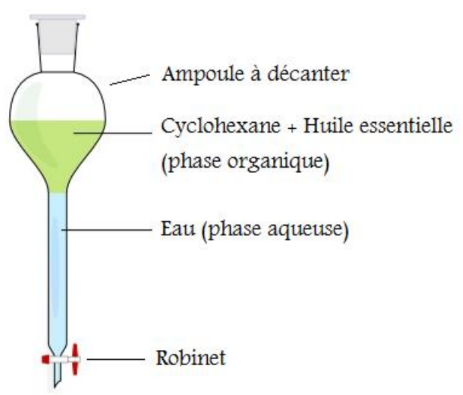
Une extraction consiste à prélever une espèce chimique du milieu qui la contient.
Lors d’une extraction liquide-liquide, une espèce présente dans un solvant est extraite par un autre solvant dans lequel elle est plus soluble.
Ce solvant est choisi tel que :
L’espèce à extraire y est plus soluble
Les deux solvants sont non-miscibles
Il présente un danger minimal pour la santé et l’environnement
Commentaires





