

Réactions de combustion
La réaction de combustion
Définition
La réaction de combustion est une réaction d’oxydo-réduction au cours de laquelle :
Un combustible (ce qui brûle) s’oxyde
Un comburant, généralement le dioxygène, se réduit.
Pour activer une combustion, une énergie doit être apportée.

Le triangle du feu = 3 conditions à réunir pour générer une réaction de combustion : un combustible, un comburant, une énergie d'activation
Définition
La combustion d’un combustible ne contenant que les éléments carbone , hydrogène et éventuellement oxygène , est dite
complète si les produits de combustion sont uniquement le dioxyde de carbone et l’eau .
Propriété
Comme toute réaction chimique, une combustion peut être modélisée par une équation de réaction.
Exemple

Différents combustibles sont actuellement utilisés pour diverses utilisations (chauffage, transport, énergie) :
Les combustibles fossiles (pétrole, charbon, gaz, ...) non renouvelables à l’échelle humaine
- Les agrocombustibles (éthanol, éther méthylique de colza, bois, etc.) produits à partir de la biomasse et renouvelables à l’échelle humaine.
Conservation de l’énergie
Énergie transférée lors d’une combustion
Définition
Lors de la combustion, le système chimique libère de l’énergie sous forme de chaleur, notée .
Les réactions de combustion étant des réactions exothermiques, elles dégagent de la chaleur et donc .
Propriété
L’énergie transférée lors de la combustion dépend de deux paramètres :
La nature du combustible
La quantité de combustible
Propriété
L'expression de peut prendre différentes formes :
avec la quantité de matière et l’énergie molaire de combustion en .
(ainsi le système libère de l’énergie)- avec la masse de combustible et le pouvoir calorifique en
(car il est défini en fonction du système chauffé)
Propriété
Il est possible de relier pouvoir calorifique et énergie molaire de combustion en utilisant la relation liant quantité de matière, masse et masse molaire. Ainsi :
Énergie molaire de combustion

Pour calculer l’énergie molaire de combustion, on part de l’équation de combustion avec un coefficient de 1 pour le combustible.
Lors d’une réaction de combustion, des liaisons sont rompues (les réactifs) et d’autres sont formées (les produits).
Il suffit donc de connaitre l’énergie de liaison des différentes liaisons des molécules et de faire la différence d’énergie entre celles rompues et celles formées.
Définition
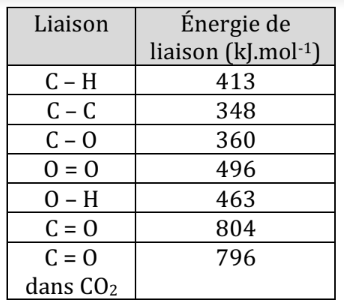
Exemple
Combustion du butane :
Les réactions de combustions sont exothermiques donc .
Les enjeux des réactions de combustion

Les réactions de combustion sont énormément exploitées dans le secteur du transport et du chauffage.
Malheureusement, les réactions de combustion émettent des gaz polluants à effet de serre tels que le dioxyde de carbone et l’eau.
De plus, lors d’une combustion incomplète (pas assez de dioxygène), du monoxyde de carbone CO est libéré, c’est un gaz toxique.
Deux enjeux pour l’avenir sont à noter :
La mise au point d’alternatives énergétiques moins polluantes et plus pérennes
L’élaboration de systèmes de combustion plus efficaces
Commentaires





