

Cohésion des solides moléculaires

Cours
Cohésion des solides moléculaires
Solides ioniques

Cours
Solides ioniques
Cohésion des solides moléculaires
Sommaire
Les solides moléculaires
Définition
Un solide moléculaire est constitué de molécules régulièrement disposées dans l’espace et qui sont statiques.
Les molécules sont généralement disposées de telle sorte que les moments dipolaires soient alignés, c’est à dire que les pôles électriques de signe opposés soient les plus proches.

La cohésion des solides moléculaires est assurée par deux types d’interactions intermoléculaires :
les interactions de Van der Waals
les liaisons hydrogènes
Ces interactions sont faibles par rapport à l'interaction électrostatique des solides ioniques.
Les interactions des Van der Waals
Définition
Les interactions de Van der Waals sont des interactions entre dipôles électriques.

Les molécules polaires vont s'aligner de telle sorte que les moments dipolaires permanents soient alignés.
Exemple
Dans l'exemple ci-dessous avec des molécules d'eau , on retrouve bien un alignement des moments dipolaires permanents (en rouge).
Exemple de l'alignement des moments dipolaires de molécules d'eau

Pour une molécule apolaire, il n’y a pas de moment dipolaire, il n’y aura donc pas d’interaction électrostatique entre les dipôles de manière permanente.
Néanmoins, à un moment donné, les électrons vont se retrouver davantage autour d’un des atomes et créer un dipôle instantané.
Ces dipôles instantanés vont également permettre aux molécules de s'aligner pour assurer la cohésion du solide moléculaire.

En conclusion, la cohésion d’un solide moléculaire peut être assurée par des interactions entre dipôles électriques permanents ou instantanés : ces interactions sont appelées interactions de Van der Waals.
La liaison hydrogène
Définition
Les liaisons hydrogène se forment entre :
- un atome d'hydrogène lié à un atome très électronégatif
- et un autre atome également très électronégatif et portant un doublet non liant.
En résumé, c'est une liaison entre un hydrogène et un doublet non-liant.
Les atomes très électronégatifs concernés sont essentiellement N, O, F et Cl.
Propriété
Les 3 atomes liés par une liaison hydrogène sont alignés.
Toute molécule possédant au moins un groupe va faire des liaisons hydrogène.
La liaison hydrogène est généralement représentée par un trait discontinu entre l'hydrogène et le doublet non-liant.
Exemple
Dans l'exemple ci-dessous :
- l'hydrogène est lié à un atome très électronégatif : l'oxygène
- la molécule comporte également un atome très électronégatif qui porte 2 doublets non liants (en rouge sur l'image) : l'oxygène (formant une double liaison )
Il va donc y avoir formation de liaisons hydrogène entre l'hydrogène du groupe et l'oxygène du groupe
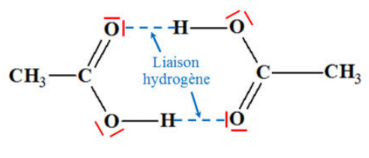
Exemple de formation de liaisons hydrogène entre deux molécules
Les changements d'état
Propriété
Pour faire changer d'état un solide moléculaire en cassant les interactions de Van der Waals et les liaisons hydrogène, le plus simple est de le chauffer.

A l’état solide, les molécules sont disposées régulièrement et ne bougent que très peu, elles vibrent autour d’une position.
En chauffant, l’énergie thermique va être transformée en énergie cinétique et les molécules vont commencer à s’agiter, tout en restant solides.
A la température de fusion, les molécules sont déjà bien agitées et toute l’énergie thermique sert alors à rompre des interactions de Van der Waals ainsi que des liaisons hydrogène présentes, mais pas toutes.
Les molécules sont alors compactes mais en mouvement, c’est un liquide.
En continuant à chauffer, c'est le phénomène de vaporisation : les interactions de Van der Waals disparaissent une à une, ainsi que les liaisons hydrogène, les molécules n’interagissent plus et sont en mouvement désordonné : c’est un gaz.
Revenir au chapitre
Commentaires
Shashiwax
1
Bonsoir,
s'il vous plait vous avez dit si j'ai bien compris que les interactions des solides moléculaires sont plus facile à casser car ils sont liées par interaction électrostatique (1:59) hors dans les solides ioniques aussi il existe des interactions électrostatiques entre les ions permettant la cohesion du solide. Par consequent je ne comprends toujours pas la raison pour laquelle ces interactions sont plus faciles à casser dans les solides moléculaires.
Merci, si on pouvait m'éclaircir svp :s





