

Ancien programme (Terminale S)

Cours
Généralités sur les réactions acide base

Cours
pH et équilibre chimique
pH et équilibre chimique
Sommaire
Toute solution aqueuse contient des ions oxonium .
La valeur de la concentration molaire peut varier entre quelques et .
En 1909, le chimiste danois S. SORENSEN proposa une grandeur plus facile à manipuler, le pH.
Définition
Pour une solution aqueuse diluée, , le pH est défini par :
Le pH est une grandeur sans unité, ici est exprimé en .

Inversement, à partir du , on peut retrouver la concentration molaire en :

Mathématiquement, le pH augmente d’une unité lorsque la concentration est divisée par 10.

Le pH augmente lorsque la concentration en diminue.
Le pH diminue lorsque la concentration en augmente.
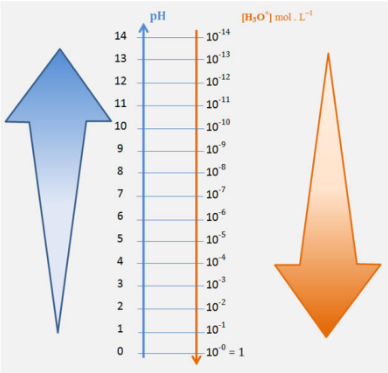
Variation du pH en fonction de la concentration en ions .

Le pH d’une solution aqueuse est mesuré avec un pH-mètre.
Pour indiquer une valeur fiable du d’une solution, un -mètre doit être préalablement étalonné avec des solutions étalons de connu.
La précision de la mesure du dépend de nombreux facteurs.
Toute concentration déduite d’une mesure de doit être exprimée avec, au plus, deux chiffres significatifs.

Un système chimique peut évoluer dans les deux sens.
L’état final est alors un état d’équilibre entre les différentes espèces chimiques.
Pour traduire cet équilibre, on utilise la double flèche au lieu de la simple flèche.
Un système atteint un état d’équilibre lorsque, dans l’état final, les réactifs et les produits sont simultanément présents.
L’équation de la réaction s’écrit alors avec une double flèche qui traduit que les deux réactions, inverses l’une de l’autre, peuvent se produire simultanément dans le système.
Revenir au chapitre
Commentaires





