

De l'atome à l'élément chimique
Structure d'un atome
Composition d'un atome
Définition
Un atome est composé d'un noyau, chargé positivement, et d'électrons, chargés négativement, qui gravitent autour de ce noyau.
Le noyau est constitué de nucléons, qui peuvent être des neutrons (neutres) ou des protons (chargés positivement).
Un atome est électriquement neutre : il possède autant de protons que d'électrons.
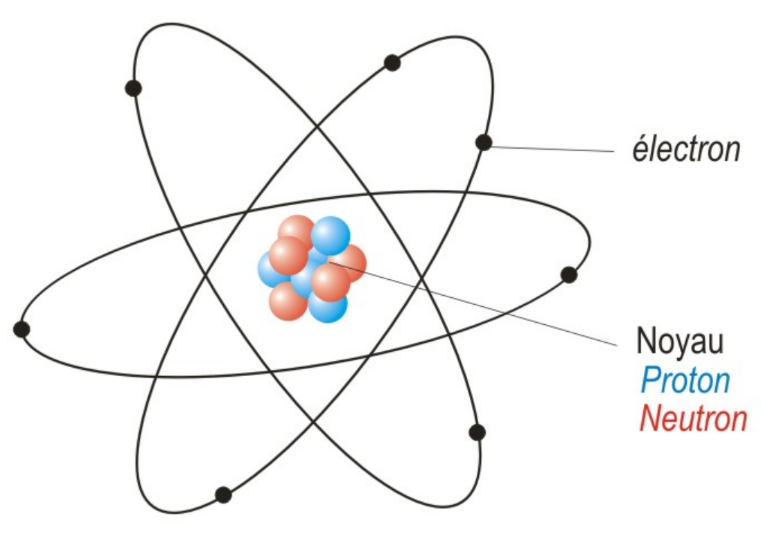
Schéma d'un atome
Représentation de l'atome
Définition
Pour désigner un atome de symbole chimique X, on adopte ce que l'on appelle une écriture conventionnelle (ou notation symbolique) :
Où :
A est le nombre de nucléons du noyau de l'atome X
Z est le nombre de protons de cet atome. On dit que Z est le numéro atomique de l'atome X.
Comme l'atome possède autant de protons que d'électrons, Z est aussi le nombre d'électrons.
Enfin, le nombre de neutrons est égal à A-Z.
Propriétés physiques de l'atome
Charge d'un atome
Propriété
Le proton, chargé positivement, a une charge électrique notée .
A l'inverse, l'électron, chargé négativement, a une charge électrique notée .
Cette charge électrique a pour valeur :
Le neutron quant à lui, n'a pas de charge.

Comme il y a autant de protons que d'électrons, et que le neutron n'a pas de charge, l'atome est bien électriquement neutre.

La charge est appelée la charge élémentaire. Son unité est le Coulomb, noté C.
Taille d'un atome
Propriété
L’ordre de grandeur du rayon d’un atome est de (soit ).
L’ordre de grandeur du noyau d’un atome est de , le rayon de l’atome est donc fois (100 000) plus grand que son propre noyau.
Remarque
Si le noyau d’un atome faisait 1 cm, l’atome correspondant ferait 1 km !

L'espace entre le noyau et les électrons est vide : on dit que l'atome a une structure lacunaire.
Masse d'un atome
Propriété
La masse d’un neutron est environ égale à celle du proton, celle de l’électron est près de 2000 fois plus faible.
La masse d’un atome est donc proche de celle de son noyau. Cela se traduit par la relation suivante :
Formation des ions
Définition
Un ion monoatomique est un ion issu d'un atome qui a gagné ou perdu un ou plusieurs électrons
Propriété
Lors du passage de l'ion à l'atome, seul le nombre électrons varie, le noyau reste inchangé et donc le nombre de nucléons ne change pas.

Il existe deux sortes d'ions :
le cation : c'est un ion qui a une charge positive. Il a donc perdu un ou plusieurs électrons.
l'anion : c'est un ion qui a une charge négative. Il a donc gagné un ou plusieurs électrons.
Exemple
Un atome de Fer () qui perd 2 électrons forme l'ion : c'est un cation.
Un atome de Chlore () qui gagne un électron forme l'ion : c'est un anion.
Element chimique
Définition d'un élément chimique
Définition
Un élément chimique, sous forme d'atome ou d'ion, est caractérisé :
par son symbole chimique : toujours sous forme d'une lettre majuscule éventuellement suivie d'une lettre minuscule
par son numéro atomique Z.
Les atomes ou ions représentant un élément chimique ont donc un noyau contenant le même nombre de protons.

Lorsqu'une réaction chimique se produit, les noyaux ne sont pas modifiés : aucun élément chimique ne peut disparaître et aucun élément chimique ne peut apparaître. On dit que les éléments chimiques se conservent.
Notion d'isotope
Définition
Des atomes ou des ions sont des isotopes s'ils ont le même nombre de protons, et donc le même numéro atomique (Z), mais des nombres de nucléons (A) différents.
Exemple
Le Carbone 14, de notation et le Carbone 12, de notation sont des isotopes. Ils ont le même numéro atomique Z = 6, et ils ont des nombres de nucléons A différents (respectivement 14 et 12).
Entité chimique et espèce chimique
Définition
Une entité chimique peut désigner un atome, une molécule, un ion ou un ensemble d’ions qui constitue la matière à l’échelle microscopique (le mot utilisé au collège est « particule »).
Une espèce chimique est un ensemble d’un très grand nombre d’entités chimiques (à l'échelle macroscopique).
Exemple
Le Fer est constitué d'atomes de Fer :
L'eau est constituée de molécules d'eau :
Le sel est constitué de paires d'ions sodium et chlorure : et
Propriété
La matière étant électriquement neutre, les atomes sont neutres, les molécules aussi, mais les ions doivent être associés pour que cela soit neutre.
Les anions et les cations sont associés dans des proportions telles que le solide ionique est neutre.
Commentaires
louloutte123
3
Ces cours aident beaucoup quand l'on a du mal .. Merci beaucoup MATHRIX
t_ina
1
Ces absolument vrai
LoolaYoon
0
dans la formule-->m-atome=A*m-nucleons, A= au nombre de nucléons ?
Ticia Nn
0
oui
Ticia Nn
0
Réponds...
t_ina
0
Ces cours aident beaucoup lors de la révision générale merci MATHRIX mais je crois qu'il y a une faute dans la formule de la représentation de l'atome
Florian
1
Ces cours associés au vidéos Mathrix sur YouTube c'est le Top vraiment merci !!





