

Réaction acide-base
Le pH
Définition
Toute solution aqueuse contient des ions oxonium .
La valeur de la concentration molaire peut varier entre quelques et .
En 1909, le chimiste danois S. SORENSEN proposa une grandeur plus facile à manipuler, le pH.
Définition
Pour une solution aqueuse diluée, , le pH est défini par :
Le pH est une grandeur sans unité, ici est exprimé en .

Inversement, à partir du , on peut retrouver la concentration molaire en :

Mathématiquement, le pH augmente d’une unité lorsque la concentration est divisée par 10.

Le pH augmente lorsque la concentration en diminue.
Le pH diminue lorsque la concentration en augmente.
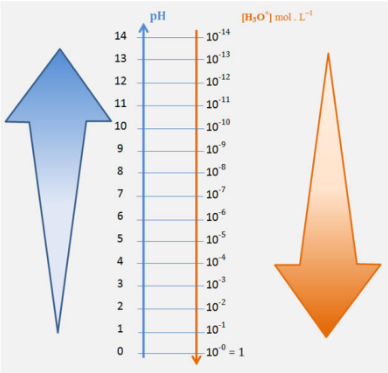
Variation du pH en fonction de la concentration en ions .
Mesure

Le pH d’une solution aqueuse est mesuré avec un pH-mètre.
Pour indiquer une valeur fiable du d’une solution, un -mètre doit être préalablement étalonné avec des solutions étalons de connu.
La précision de la mesure du dépend de nombreux facteurs.
Toute concentration déduite d’une mesure de doit être exprimée avec, au plus, deux chiffres significatifs.
L'équilibre chimique

Un système chimique peut évoluer dans les deux sens.
L’état final est alors un état d’équilibre entre les différentes espèces chimiques.
Pour traduire cet équilibre, on utilise la double flèche au lieu de la simple flèche.
Un système atteint un état d’équilibre lorsque, dans l’état final, les réactifs et les produits sont simultanément présents.
L’équation de la réaction s’écrit alors avec une double flèche qui traduit que les deux réactions, inverses l’une de l’autre, peuvent se produire simultanément dans le système.
Acide et base selon Brönsted
Définitions
Définition
Selon la théorie du chimiste danois J. BRÖNSTED (1879-1947) :
Un acide est une espèce chimique capable de céder au moins un proton (ou ion hydrogène).
Une base est une espèce chimique capable de capter au moins un proton .
Couples acide-base
Définition
Un couple acide/base est défini par la demi-équation acido-basique :
L’acide et la base sont dits conjugués l’un de l’autre.
Remarque
On peut aussi écrire les couples sous la forme comme c’est le cas pour le couple .
Couples de l'eau

L'eau appartient à deux couples acido-basiques : et , caractérisés par les deux demi-équations suivantes :
On dit que l'eau est un ampholyte.
Réaction acido-basique
La réaction entre l’acide éthanoïque et l’eau met en jeu les deux couples : et suivant les demi-équations :
Ce qui donne l'équation bilan suivante :
Un transfert de proton a lieu entre les deux couples en présence.
Acide faible et base faible
Définition
Un acide HA est faible si sa réaction avec l’eau n’est pas totale.
Par exemple, les acides carboxyliques sont des acides faibles dans l’eau.
Une base est faible si sa réaction avec l’eau n’est pas totale.
Par exemple, les ions carboxylate et les amines sont des bases faibles dans l’eau.
Remarque
Un amphion résulte du transfert interne d’un proton du groupe carboxyle vers le groupe amine d’un acide -aminé.
Ce transfert est une réaction acido-basique intramoléculaire.
L’amphion est un ampholyte, comme l’eau.
Constante d'acidité
Produit ionique de l'eau

L’eau est un ampholyte, il y a donc une réaction entre la molécule d’eau acide d’un couple et une autre molécule d’eau base d’un autre couple.
Définition
La réaction d'équation :
est appelée autoprotolyse de l'eau
L'autoprotolyse de l'eau est très limitée dans le sens direct de l'équation.
Elle a lieu dans toutes les solutions aqueuses.
Définition
Toute solution aqueuse contient donc des ions et dont les concentrations sont reliées par le produit ionique de l’eau.
Le produit ionique de l’eau est défini par :
Les concentrations étant en .
n’a pas d’unité et ne dépend que de la température.
A °C, pour toute solution aqueuse, .
Définition
On définit aussi le pKe tel que :
Soit donc :
A °C, .

Dans une solution neutre :
Donc :
D'où :
Et :
Car :

On en conclue donc que :
Pour une solution neutre :
Pour une solution acide :
Pour une solution basique :
Constante d'acidité
Définition
Soit un couple dont l’acide réagit avec l’eau selon la réaction d’équation :
La constante d’acidité du couple est la valeur numérique du quotient :
Par définition :
Soit :

Le caractérise l’aptitude d’un acide à céder un proton ou celle d’une base à l’accepter. Pour une même concentration en soluté :
un acide est d’autant plus fort qu’il cède facilement un proton et que le du couple est petit
une base est d’autant plus forte qu’elle capte facilement un proton et que le du couple est grand
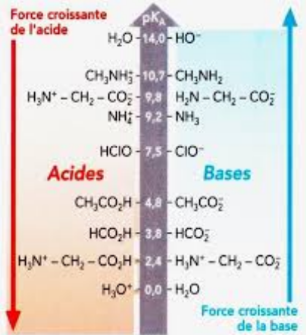
Valeurs de pour quelques couples acide/base dans l'eau.

Les valeurs extrêmes de l’échelle des sont celles des des couples de l’eau.
A savoir, en solution aqueuse l’acide le plus fort est et la base la plus forte
Domaines de prédominance
Pour tout couple , on peut écrire :
Soit :
Ou encore :

Plus généralement :

Avec une analyse mathématique on comprend que :
Si , alors ; aucune espèce ne prédomine.
Si ; prédomine sur .
Si , alors ; prédomine sur .

On peut illustrer cela avec un diagramme de prédominance ci-dessous :
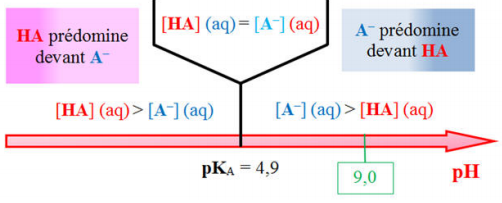
Diagramme de prédominance.
Définition
Il existe des solutions donc le varie très peu, ce sont les solutions tampon.
Une solution tampon est une solution dont la composition est telle que le pH varie peu par ajout de petites quantités d’acide ou de base ou par dilution.
Les solutions tampons existent dans les systèmes vivants et sont utilisées par exemple pour étalonner un pH-mètre.
Acide fort et base forte
Définitions
Définition
Un acide est fort dans l’eau si sa réaction avec l’eau est totale.
L’équation de cette réaction s’écrit alors avec une simple flèche :
Le pH d’une solution diluée d’acide fort, de concentration en soluté apporté est :
Le chlorure d’hydrogène et l’acide nitrique sont des acides forts dans l’eau.
Définition
Une base est forte dans l’eau si sa réaction avec l’eau est totale.
L’équation de cette réaction s’écrit alors avec une simple flèche :
Le pH d’une solution diluée de base forte, de concentration en soluté apporté est :
Les ions amidure, éthanolate et l’hydroxyde de sodium sont des bases fortes dans l’eau.
Réaction entre un acide fort et une base forte

L’équation de réaction entre un acide fort et une base forte est :
C’est la réaction inverse de la réaction d’autoprotolyse de l’eau.
La réaction entre un acide fort et une base forte libère de l’énergie thermique et s’accompagne donc d’une élévation de température.
Commentaires
Anna
0
lim cest la limite
Mitsuki
1
oui
flav01
0
comment determiner co ?
Bobbob
0
co c'est toujours 1
Lara
0
ou sont les interro?
ninon
0
Ecris un commentaire..
Piltack
0
Ecris un commentaire..
Sabri
0
Où sont les exercices pour la partie chimie ?
Sabri
0
Où sont les exercices pour la partie chimie ?
Astou
0
C'est bien résumé !!
Bobbob
0
C'est un peu long je trouve pour un résumé





