

Corps purs et mélanges
Les corps purs et les mélanges
Définitions
Définition
Une espèce chimique est un ensemble d’entités chimiques (atomes, ions, molécules, ...) identiques.
Elle est représentée par une formule chimique.
Exemple
La formule de l’eau est , celle du cuivre est , celle de l’ion sodium est .
Définition
Un corps pur est constitué d’une seule espèce chimique.
Un mélange est constitué de plusieurs espèces chimiques.
Exemple
Le dioxygène et le diazote sont des corps purs, l’air est un mélange de gaz.
L’eau et le sucre sont des corps purs, l’eau sucrée est un mélange.
Définition
On peut classer les mélanges en deux catégories :
- Les mélanges homogènes, pour lesquels on ne peut pas différencier à l’œil nu les constituants
- Les mélanges hétérogènes, pour lesquels tous les constituants ou une partie sont visibles à l’œil nu
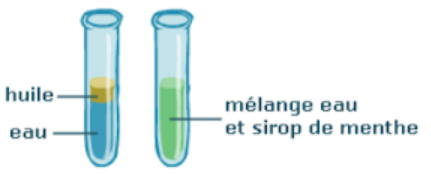
Exemples de mélange hétérogène (à gauche) et de mélange homogène (à droite)
Définition
Deux liquides sont miscibles s’ils forment un mélange homogène.
Deux liquides sont non-miscibles s’ils forment un mélange hétérogène.
Proportions
Propriété
Pour tout mélange, on peut détailler sa composition en indiquant les proportions de chaque constituant.
Définition
La proportion en masse d’une espèce E dans un mélange est le quotient de la masse de cette espèce par la masse du mélange (les masses doivent être exprimées dans la même unité) :
Si cette proportion est exprimée en %, alors on parle de pourcentage massique.
Définition
La proportion en volume d’une espèce E dans un mélange est le quotient du volume de cette espèce par le volume du mélange (les volumes doivent être exprimés dans la même unité) :
Si cette proportion est exprimée en %, on parle alors de pourcentage volumique.
Exemple
L’air contient en volume, environ 78% de diazote, 21% de dioxygène et 1% d’autres gaz.
Identification des espèces
Par les grandeurs physiques

Les corps purs ont des caractéristiques physiques qui leur sont propres et permettent donc de les identifier.
On trouve parmi ces caractéristiques physiques :
Les températures de changement d'état
La masse volumique et la densité
La solubilité
L'indice de réfraction
Propriété
Il a été vu au collège que les changements d’états étaient différents pour les corps purs et les mélanges.
Ainsi un corps pur changera d’état à une température qui restera fixe toute la durée du changement d’état.
Un mélange par contre ne change pas d’état à une température fixe.
Deux températures de changement d’état peuvent permettre d’identifier un corps pur :
La température de fusion (solide à liquide) avec un banc Köfler
La température d’ébullition (liquide à gaz) avec un thermomètre
Définition
La masse volumique, comme vu au collège, est aussi une caractéristique d’un corps pur et peut être mesurée assez facilement. En effet, celle-ci dépend de la température et s’exprime par la relation :
Avec :
en
en
en
Définition
La densité d’un liquide ou d’un solide s’exprime par rapport à celle de l’eau et on a donc :
Les deux masses volumiques étant dans la même unité, la densité n’a pas d’unité.
Définition
La densité d’un gaz s’exprime par rapport à celle de l’air et on a donc :
Propriété
La comparaison des masses volumiques (ou des densités) dans le cas de mélanges hétérogènes permet de connaitre les positions relatives des espèces.
L'espèce la plus dense est toujours en-dessous.
Par des tests chimiques
Propriété
Il existe de nombreux tests chimiques pour identifier des espèces qu’elles soient dans un mélange ou sous forme de corps purs.
Il faut en connaitre 4 :
- Le test de l’eau par le sulfate de cuivre anhydre qui devient bleu en présence d’eau (1ère photo ci-dessous)
Le test du dioxyde de carbone par l’eau de chaux qui se trouble en sa présence (2ème photo ci-dessous)
Le test du dioxygène avec une allumette incandescente qui prend feu en sa présence (3ème photo ci-dessous)
Le test du dihydrogène avec une flamme qui provoque une détonation (4ème photo ci-dessous)

Par chromatographie
Définition
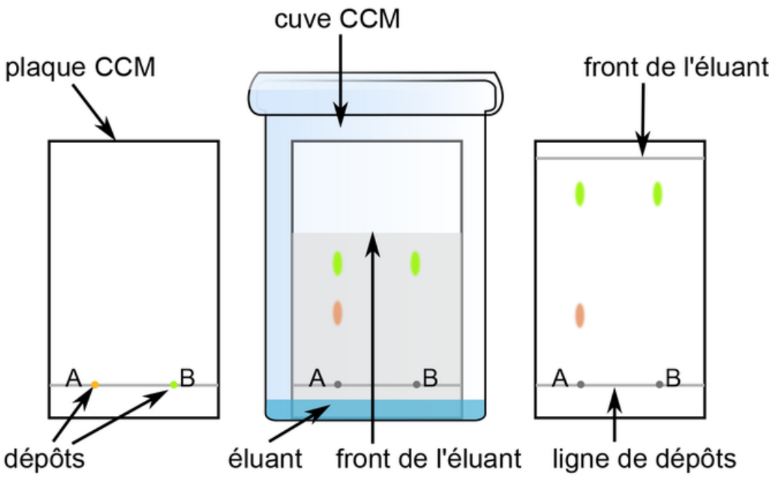
La chromatographie permet d’identifier les espèces chimiques présentes dans un mélange ou dans un corps pur. Elle se base sur les différences de solubilité.
Les espèces chimiques sont entraînées par une phase mobile (l’éluant) dans une phase fixe composée de papier ou de silice. La figure obtenue est appelée chromatogramme.
Propriété
Pour un éluant et un support donné, une espèce chimique migre toujours de la même façon, que ce soit en corps pur ou en mélange, ce qui permet son identification.

Les tâches sur un chromatogramme ne sont pas toujours visibles, il est parfois nécessaire de passer par une étape de révélation.
Les tâches apparaissent sous une lampe UV ou à l’aide d’un révélateur chimique.

On peut exploiter un chromatogramme en mesurant la distance qui sépare le centre de la tâche à la ligne de dépôt et en comparant avec une espèce connue.
Commentaires
maelleB
0
Je ne comprend pas le principe de Chromatographie sinon le reste est super
ines_fhr
1
Salut ! La chromatographie sert à connaître la contenance d’un mélange. Les espèces chimiques migrent, et si elles migrent au même niveaux que d’autre espèce chimique c’est que le mélange contient cette espèce chimique. J’espère que tu as compris ?
Ambre Thuillier
1
excellent conseils
Ervelor Gilet
0
Oui bien-sûr
Ervelor Gilet
0
Oui bien-sûr
Ervelor Gilet
0
Oui bien-sûr
Ervelor Gilet
0
Oui bien-sûr
Ervelor Gilet
0
Oui bien-sûr
MALAK12
0
salut! comment calculer les rapports frontaux svp





